
【题目】(1)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是___________.
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___________方向移动.
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___________态.
(2)乙二酸俗名草酸,易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
某学习小组的同学设计了如下实验方法测草酸晶体(H2C2O4·xH2O)中x值。
①称取1.260g纯草酸晶体,将其酸制成100.00mL水溶液为待测液
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL;
(1)滴定时,KMnO4标准液应装在 式滴定管中
(2)本实验滴定达到终点的标志是___________
(3)通过上述数据,计算出x=___________
讨论:若滴定终点时俯视滴定管刻度,则由此测得的x值会___________(填“偏大”、“偏小”或“不变”)。
【答案】(1)①m+n > P;②逆反应;③气;(2)①酸;②当滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色,且半分钟内不褪色,即达滴定终点;③2;偏大。
【解析】
试题分析:(1)①减压,正反应速率小于逆反应速率,说明反应向逆反应方向进行,根据勒夏特列原理,m+n>p;②m+n=p,因此p>m,p>n,如果C为气体,加压平衡发生移动,说明A和B至少有一种是非气态物质,根据勒夏特列原理,加压平衡向逆反应方向移动;③纯液体和固体浓度视为常数,增加B的量,化学平衡不移动,说明B是固体或液体;(2)(1)高锰酸钾具有强氧化性,因此应装在酸式滴定管;(2)当滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色,且半分钟内不褪色,即达滴定终点;(3)根据离子反应方程式n(H2C2O4)=10×10-3×0.1×5×100/(2×25)mol=1×10-2mol·,草酸的质量为0.01×90g=0.9g,结晶水的质量为0.36g,结晶水的物质的量0.36/18mol=0.02mol,即x=2,滴定管从上到下数值增大,俯视读数,消耗高锰酸钾的物质的量减小,草酸的质量减小,结晶水的质量增大,即x增大。


科目:高中化学 来源: 题型:
【题目】若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol,反应产物中的有机物只是四氯乙烷) ( )
A.取代反应 4 mol Cl2 B.加成反应 2 mol Cl2
C.加成反应、取代反应 2 mol Cl2 D.加成反应、取代反应 3 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器,其太阳能电池帆板的材料是晶体硅
C. “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
D. “一带一路”是现代“丝绸之路”,丝绸的主要成分是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子,是产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。人体缺E元素会得软骨病,D与E位于同主族。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C非金属性由强到弱的顺序为________。
(2)B的氢化物的分子式是________,B的氢化物溶于水的电离方程式为
________________________________________________________________________。
(3)写出化合物AC2的电子式:________,它是________(填“极性”或“非极性”)键形成的非极性分子。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的0.1 mol/L醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
A.加少量盐酸 B.加热 C.加少量醋酸钠晶体 D.加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
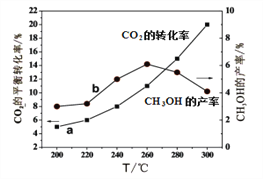
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的叙述正确的是
A. 向淀粉溶液中加入碘水后,溶液变蓝色
B. 蛋白质纤维素、蔗糖、PVC都是高分子化合物
C. 硫酸铜溶液、硫酸铵溶液均可使蛋白质发生变性
D. 变质的油脂有难闻的特味气味,是由于油脂发生了水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com