
| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
分析 短周期元素W、X、Y、Z 的原子序数依次增大,植物生长不可缺少的三种营养元素为N、P、K,W为三者之一,而且原子序数较小,所以W为N元素,Z原子的L层电子数比其最外层电子数多5,则Z的各层上的电子数为2、8、3,所以Z为Al;X、Y、Z的简单离子的电子层结构相同,N与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,则Y为F元素,X为O元素,据此解答.
解答 解:短周期元素W、X、Y、Z 的原子序数依次增大,植物生长不可缺少的三种营养元素为N、P、K,W为三者之一,而且原子序数较小,所以W为N元素,Z原子的L层电子数比其最外层电子数多5,则Z的各层上的电子数为2、8、3,所以Z为Al;X、Y、Z的简单离子的电子层结构相同,N与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,则Y为F元素,X为O元素,
A.W为N元素,X为O元素,单质的沸:O2>N2,故A错误;
B.Y为F元素,没有正化合价,故B错误;
C.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径:r(F)<r(O)<r(N)<r(Al),故C错误;
D.N、O能存在于同一离子化合物中,如硝酸铵,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意利用电子排布的知识和元素在周期表中的位置关系推断元素,对学生的逻辑推理有一定的要求,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cu2+、NO3- | B. | Na+、Al3+、OH-、Cl- | ||
| C. | Ag+、K+、Cl-、OH- | D. | Na+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑧ | B. | ①②③④⑤⑧ | C. | ②③④⑤⑧ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN溶液,溶液变成血红色,说明该溶液中一定含有Fe3+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明Fe2+是被HClO所氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为AgS | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应的还原剂是H2S | D. | 每生成1mo1X转移2mo1电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
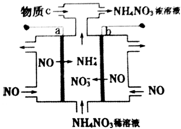
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、O2混合气体和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | NO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
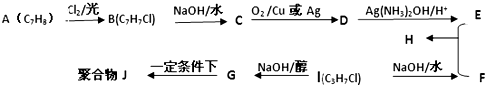
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
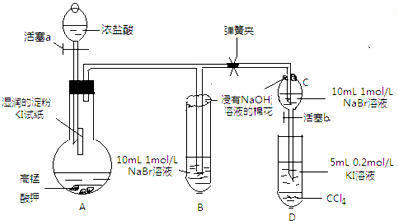 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com