
钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的含钇矿石(YxeBe2Si2O10).现将4.68g矿样与过量的NaOH共熔,反应后加适量水溶解,过滤.滤渣中有Y(OH)3、Fe2O3(反应中Fe由+2价变为+3价),滤液中有Na2SiO3、Na2BeO2等.将滤液配成1L溶液,测知pH值为13(C(OH)=0.1mol/L),往此滤液中加入3.3mol/L盐酸100mL,结果pH值为1(C(H)=0.1mol/L),反应过程如图:
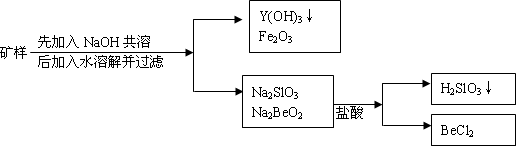
求Y元素的相对原子质量及X值.
|
解:YxFeBe2Si2O10中元素化合价代数和为零,所以
因滤液1.0LpH=13所以[OH-]=10-1mol·L-1nOH-=10-1×1.0=0.10mol 加入盐酸后为1.1LpH=1所以[H+]=10-1nH+=10-1×1.1=0.11mol 故SiO32-、BeO22-消耗的盐酸为 3.3mol·L-1×0.1L-0.11mol-0.10mol=0.12mol 由Y2Fe2Si2O10——2Na2SiO3+2Na2BeO2——12HCl 112 0.01 0.12 所以矿石的式量为: Y的相对原子质量为(468-56-2×9-2×28-10×16)÷2=89(6分) |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源:四川省绵阳中学2011届高三化学考前热点训练:14工艺流程、无机综合题 题型:022
稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

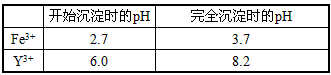
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:

②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为________.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、________(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液
b.氨水
c.CO2气
d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:________.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在________的范围内;检验Fe3+是否沉淀完全的操作方法是________.
查看答案和解析>>
科目:高中化学 来源:江苏省某重点中学2012届高三10月月考化学试题 题型:022
稀土元素是周期表中ⅢB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
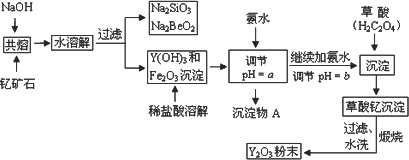
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:

②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为________.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、________(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液
b.氨水
c.CO2气
d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:________.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在________的范围内;继续加氨水调节pH=b发生反应的离子方程式为________,检验Fe3+是否沉淀完全的操作方法是________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题
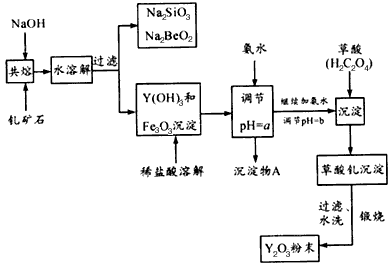
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com