
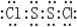 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl分析 W、X、Y、Z四种短周期元素,原子序数依次增大,X、Y位于同一族,它们能组成YX2,YX3两种常见化合物,则X为O元素、Y为S元素,在周期表中W与X相邻、Y与Z相邻,结合原子序数可知W为N元素、Z为Cl,W元素的氢化物与Z元素的氢化物反应只生成一种盐a为NH4Cl,据此解答.
解答 解:W、X、Y、Z四种短周期元素,原子序数依次增大,X、Y位于同一族,它们能组成YX2,YX3两种常见化合物,则X为O元素、Y为S元素,在周期表中W与X相邻、Y与Z相邻,结合原子序数可知W为N元素、Z为Cl,W元素的氢化物与Z元素的氢化物反应只生成一种盐a为NH4Cl.
(1)X为O元素,在周期表中的位置为:第二周期VIA族,故答案为:第二周期VIA族;
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是S,故答案为:S;
(3)NH4Cl溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性,故pH<7,
故答案为:<;NH4++H2O?NH3•H2O+H+;
(4)Y与Z可形成共价化合物S2Cl2,分子中Y与Z均满足8电子稳定结构,则S2Cl2的电子式为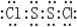 .S2Cl2遇水很易反应,产生的气体能使品红溶液褪色,反应有SO2生成,由电子转移守恒可知应有S生成,则其与水反应的化学方程式为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl,
.S2Cl2遇水很易反应,产生的气体能使品红溶液褪色,反应有SO2生成,由电子转移守恒可知应有S生成,则其与水反应的化学方程式为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl,
故答案为: ; 2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
; 2S2Cl2+2H2O═SO2↑+3S↓+4HCl;
(5)已知:①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
根据盖斯定律,①-②×2可得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生对知识的迁移应用,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若T1=T2,则x1>x2 | B. | 若T1=T2,则x1<x2 | C. | 若T1<T2,则x1=x2 | D. | 若T1<T2,则x1<x2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,出现白色沉淀,再加稀硝酸溶液,若沉淀不溶解,则该溶液中肯定有SO42- | |
| B. | 灼烧某白色粉末,火焰呈黄色,则证明原粉末中肯定有Na+,无K+ | |
| C. | 向某溶液中滴加AgNO3溶液后,出现白色沉淀,再加稀盐酸,若沉淀不溶解,则证明溶液中肯定有Cl- | |
| D. | 在某盐溶液中加入氢氧化钠浓溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中肯定有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com