
【题目】将如图所示实验装置的K闭合,下列判断错误的是( )

A. Cu电极上发生还原反应
B. 电子沿Zn→a b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大
)增大
D. 片刻后可观察到滤纸a点变红色
【答案】C
【解析】A、锌比铜活泼,锌作负极,铜作正极,根据原电池的工作原理,正极上发生还原反应,A正确;B、闭合K构成原电池,锌比铜活泼,锌作负极,铜作正极,根据原电池工作原理,电子从Zn流出,达到a,在滤纸上没有电子的通过,只有阴阳离子的定向移动,电子从b流向Cu,B正确;C、盐桥的作用是形成闭合回路,平衡两烧杯的电荷守恒,因此Cl-流向甲池,溶液中c(SO42-)不变,C错误;D、滤纸相当于电解池,b接电源的正极,b作阳极,发生电极反应式为4OH-4e-=2H2O+O2↑,a接电源的负极,作阴极,电极反应式为2H2O+2e-=H2↑+2OH-,因此a极变红,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】I.铁及其化合物之间的相互转化可用下式表示:
![]()
回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是_____________________________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的氧化剂是______________,每生成l mol Na2FeO4转移_____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为______________________。
II.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4·7H2O。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式沉淀时的pH如下:

(1)“碱浸”过程中发生反应的物质是_________________(填化学式)。
(2)“酸浸”时所加入的酸是 _________________ (填化学式)。
(3)加入H2O2时发生反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个恒压的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应![]()
![]()
![]() ,经一段时间后,甲、乙两容器反应都达到平衡,下列说法中正确的是
,经一段时间后,甲、乙两容器反应都达到平衡,下列说法中正确的是
A. 平均反应速度:![]() B. 平衡时C的物质的量甲>乙
B. 平衡时C的物质的量甲>乙
C. 平衡时C的转化率:乙<甲 D. 平衡时A的物质的量甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物主要用于医药、照相及染料等。碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
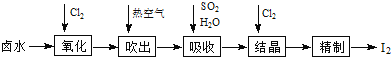
回答下列问题:
(1)“氧化”时,Cl2过量会将I2氧化为HIO3,写出生成HIO3的化学方程式_________;
(2)“吹出”在吹出塔中进行,含碘卤水从_________(填“塔顶”或“塔底”,下同)进入,热空气从_________进入,理由为_________;
(3)吸收塔应选择耐酸材料,原因是_________;
(4)结晶时,发生反应的离子方程式为_________;
(5)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_________;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO3-进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、IO3-的物质的量之比为_________;
(6)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为IO3-,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
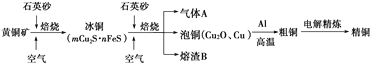
(1)气体A中的大气污染物可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存在Fe2+的方法是________________________(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 ________________________________
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________.
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是

选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com