
(1)化学反应CH3OH(l)+NH3(g)![]() CH3NH2(g)+H2O(g),在某温度下自发进行,若反应的|ΔH|==17KJ/mol,|ΔH-TΔS|==17 KJ/mol,则:ΔH________0(填写“>”、“<”或“=”下同).
CH3NH2(g)+H2O(g),在某温度下自发进行,若反应的|ΔH|==17KJ/mol,|ΔH-TΔS|==17 KJ/mol,则:ΔH________0(填写“>”、“<”或“=”下同).
(2)充分燃烧1 mol只含碳、氢、氧的有机物,所需氧气9 mol,产生二氧化碳8 mol.则符合该条件的有机物的通式为________(用n表示氧原子个数).
科目:高中化学 来源:江苏省无锡一中2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 ( ),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________,
![]() (2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________。
(2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________。
A. v(CH3OH) =2v(H2S)
B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变
D. 恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K= ____________________。
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
方法一:4NO2(g)+O2(g) =2N2O5(g);△H=-56.76KJ·mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S __________ 0(填“>、<”或“=”)
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5。工作原理如下图:
硼氢化钠燃料电池的正极反应式________________________。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省苏锡常镇四市高三调研测试(一)化学试卷 题型:填空题
(10分)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 ( ),有关反应如下:
),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________, (2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________ 。
(2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________ 。
| A.v(CH3OH) =" 2v(H2S)" |
| B.恒容容器中,体系的压强不再改变 |
| C.恒容容器中,体系中气体的密度不再改变 |
D.恒容容器中,气体的摩尔质量不 再改变 再改变 |
 ;△H=-56.76 KJ·mol-1
;△H=-56.76 KJ·mol-1 
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省苏锡常镇四市高三调研测试(一)化学试卷 题型:填空题
(10分)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 ( ),有关反应如下:
),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________,
 (2)能说明反应2CH3OH(l)+H2S(g)
(CH3)2S(l) +2H2O(l)达平衡状态的是____________
。
(2)能说明反应2CH3OH(l)+H2S(g)
(CH3)2S(l) +2H2O(l)达平衡状态的是____________
。
A. v(CH3OH) = 2v(H2S)
B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变
D. 恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K= ____________________。
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
方法一:4NO2(g)+O2(g) =2N2O5(g); △H=-56.76 KJ·mol-1 [来源:学#科#网Z#X#X#K]
常温下,该反应能逆向自发进行,则逆向反应的△S __________ 0(填“>、<”或“=”)
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5。工作原理如下图:

硼氢化钠燃料电池的正极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 (![]() ),有关反应如下:
),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________,
![]() (2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________ 。
(2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________ 。
A. v(CH3OH) = 2v(H2S)
B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变
D. 恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K= ____________________。
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
方法一:4NO2(g)+O2(g) =2N2O5(g) ; △H=-56.76 KJ·mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S __________ 0(填“>、<”或“=”)
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5。工作原理如下图:
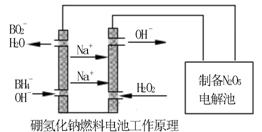
硼氢化钠燃料电池的正极反应式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com