
 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50× 10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- 2CO2+N2中气体减少,则△S<0非自发,
2CO2+N2中气体减少,则△S<0非自发, 2CO2+N2
2CO2+N2 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:不详 题型:单选题
 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是
2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为| A.25℃时,该反应的平衡常数K=0.2 |
| B.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大 |
| D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )| A.0.24 mol·L-1 | B.0.28 mol·L-1 |
| C.0.32 mol·L-1 | D.0.26 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
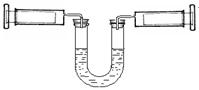
| A.左侧气体颜色先变深后逐渐变浅 |
B.对于2NO2 N2O4平衡体系 ,向生成N2O4的方向移动 N2O4平衡体系 ,向生成N2O4的方向移动 |
| C.压缩后U型管内两侧液面仍然保持水平 |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com