
下列叙述正确的是
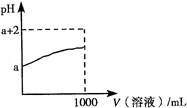
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)= c(NH4+)
B.pH = 3的醋酸溶液,稀释至10倍后pH = 4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 减小
CD
【解析】
试题分析:A中根据电荷守恒可知,2c(SO42-)+c(OH-)=c(NH4+)+c(H+),弱于显中性,则c(OH-)=c(H+),所以2 c(SO42-)=c(NH4+),A不正确;醋酸是弱酸,存在电离平衡,稀释促进电离,所以B中稀释至10倍后pH小于4,B不正确;C中醋酸的浓度大于0.001mol/L,则反应后醋酸过量,溶液显酸性,C正确;氨水是弱电解质,存在电离平衡,加入硫酸铵后增大c(NH4+),抑制氨水的电离,溶液的碱性降低,D正确,答案选CD。
考点:考查溶液中离子浓度关系、大小比较以及外界条件对电离平衡对影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
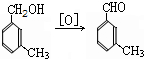
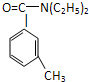 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH| SOCl2 |
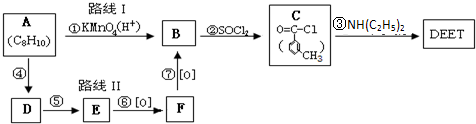
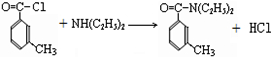
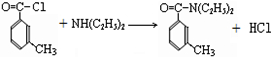

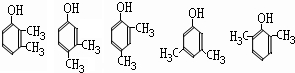 (任写2种)
(任写2种) (任写2种)
(任写2种)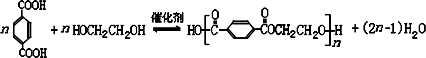

查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O+H+
NH3?H2O+H+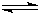 NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
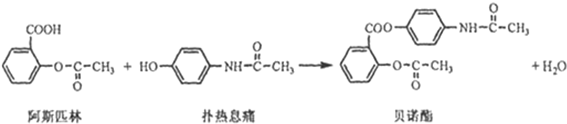
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com