
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
31.答案(16分)
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol (2分)
(2)①0.15 mol/(L·min) (2分)
②D (2分) ③0.15 mol-2.L2 (2分) ④> (2分)
(3)①2S22- - 2e-=S42- (2分) ②CO2+8e-+6H2O=CH4+8OH-(2分)
(4)CD (2分)
【解析】
试题分析: (1)根据已知方程式和盖斯定律可得,甲醇不完全燃烧的化学方程式=(①-②+4×③)/2,所以方程式为CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol。
(2)①v(H2)=3 v(CH3OH)=0.075 mol/(L·min)
②从30分钟到35分钟的过程中,甲醇的浓度瞬间没有增大,而是逐渐增大,所以该时刻改变的条件不可能是增大压强;由于加催化剂不能改变甲醇的浓度,所一不可能是加入了催化剂;升高温度平衡左移,甲醇浓度减小,所以C错误;故只能是增大了反应物的浓度,使平衡逐渐右移,甲醇浓度逐渐增大,达到新的平衡,故选D。
③因为在35分钟时改变的条件是增大了反应物浓度,所以没有改变温度,所以达到新平衡时的平衡常数与原平衡常数相等,因此有: CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
初始浓度(mol/L): 1 3 0 0
转化浓度(mol/L): 0.5 1.5 0.5 0.5
平衡浓度(mol/L): 0.5 1.5 0.5 0.5
所以平衡常数K=c(CH3OH) c(H2O)/ c(CO2) c3(H2)= 0.5× 0.5 / 0.5× 1.53 ≈0.15 mol-2.L2 .
④在30min再充入等量的反应物,相当于增大了压强,平衡要正向移动,所以达到新平衡后甲醇的浓度比原来平衡时甲醇浓度的2倍还大,因此CH3OH的浓度大于1mol.L-1 。
(3)①从所给的原电池反应式可以看出S的化合价升高,所以Na2S2 做氧化剂在负极失去电子被还原,所以反应式为2S22- - 2e-=S42- 。
②电解池中由CO2生成CH4,可以看出生成甲烷的电极是阴极,发生还原反应,由于是碱性环境,所以式子中少O的一端生成OH-,所以电极反应式为:CO2+8e-+6H2O=CH4+8OH- 。
(4)由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,图象为在碳酸中逐滴滴加氢氧化钠溶液的图象,故A错误; pH为6.37时,c(H2CO3)=c(HCO3-),pH=10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误; pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;因此选CD。
考点:本题考查的是反应原理题。


科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是
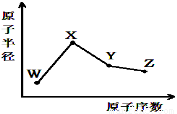
A.对应气态氢化物的稳定性:Y>Z
B.化合物XZW既含离子键也含共价键
C.对应简单离子半径:W>X
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
某元素在化学反应中由化合态变为游离态,则该元素
A.一定被氧化了 B. 一定被还原了
C.既可能被还原也可能被氧化 D.既不可能被氧化又不可能被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:填空题
配制250mL 0.5mol/L NaOH溶液,在下列仪器中:
A 托盘天平 B 量筒 C烧杯 D 玻璃棒 E 漏斗 F 500mL容量瓶
G 药匙 H 250mL容量瓶 I、 J 坩埚
需要用到的仪器有
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:选择题
将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为:
A.3:2:1 B.1:2:3 C.1:3:2 D.3:1:1
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
常温下,对于下列电解质溶液,说法正确的是( )
A.pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存
B.在c(SO )=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
)=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
C.工业上用过量的NaOH溶液吸收SO2:SO2 + OH- == HSO3-
D.将AlCl3溶液滴入NaOH溶液中反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:填空题
(本题16分)工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________ ________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①脱氢反应的△H_____0,600K时,Y点甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②从Y点到X点可采取的措施是_______________________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由__________________________________________________________________________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3-OH的脱氢实验:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)用CH3-OH、空气、KOH溶液和石墨电极可构成燃料电池。则该电池的负极反应式为:
___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:选择题
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
B | Na2O2使酚酞溶液变红 | Na2O2是碱性氧化物 |
C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用叙述正确并且有因果关系的是
A.烧碱具有碱性,能用于治疗胃酸过多
B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅
C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟
D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com