
| A. | 离子半径:K+>Cl->Na+>F- | B. | 酸性:H2SO4>H3PO4>H2CO3>H2SiO3 | ||
| C. | 熔点:石英>食盐>钾>干冰 | D. | 还原性:NaCl>NaBr>NaI>Na2S |
分析 A.电子层数越多,半径越大,具有相同电子数的离子,质子数越大,半径越小;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.熔点:原子晶体>离子晶体>分子晶体,K是金属晶体,熔点较低;
D.非金属性越强,阴离子的还原性越弱.
解答 解:A.K+与Cl-有3个电子层,Na+与F-有2个电子层,电子层数越多,半径越大,具有相同电子数的离子,质子数越大,半径越小,因此离子半径:Cl->K+>F->Na+,故A错误;
B.因非金属性:S>P>C>Si,故酸性:H2SO4>H3PO4>H2CO3>H2SiO3,故B正确;
C.石英是原子晶体,食盐是离子晶体、K是金属晶体、干冰是分子晶体,K是金属晶体,熔点较低,熔点:石英>食盐>钾>干冰,故C正确;
D.因非金属性Cl>Br>I>S,故还原性:Na2S>NaI>NaBr>NaCl,故D错误;
故选BC.
点评 本题考查了微粒半径大小比较、金属性和非金属性、晶体熔点高低等方面知识,综合性强,明确常见的比较的方法是解答本题的关键,注意知识的归纳整理,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丁>丙>乙 | |
| B. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 | |
| C. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
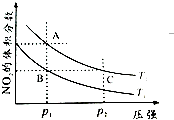 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是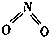 和
和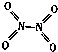 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作干燥剂 | |
| B. | 二氧化硅可用作计算机的芯片 | |
| C. | 硅酸钠是制备木材防火剂的原料 | |
| D. | 用纯碱、石灰石、石英为原料可制普通玻璃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com