
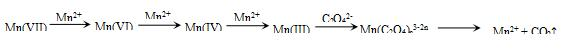
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
分析 I.(1)H2O2溶液在Fe3+催化下分解产生水和氧气;
(2)①根据化合价代数和为0计算Fe的化合价;
②过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大;
Ⅱ.(3)根据n=CV 和m=nM来计算;根据配制一定物质的量浓度的溶液的步骤是:计算、称量、溶解、移液、洗涤、定容、摇匀来选择使用的仪器;
(4)利用控制变量法来探究K+对该反应有无催化作用,从而得出加入水的体积;通过溶液褪色的时间来分析假设的成立与否.
解答 解:I.(1)H2O2溶液在Fe3+催化下分解产生水和氧气,方程式为:2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑;
(2)①CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为$\frac{4×2-(2x+2-2x)}{2}$=+3,
故答案为:+3;
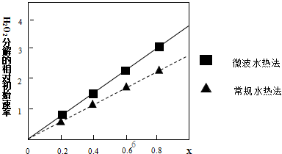
②过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;
由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案为:微波水热;Co2+;
Ⅱ.(3)配制500mL 0.10mol/L H2C2O4溶液,所需的草酸的物质的量n=CV=0.5L×0.10mol/L=0.05mol,即需要的草酸晶体(H2C2O4•2H2O)的物质的量为0.05mol,质量m=nM=0.05mol×126g/mol=6.3g;配制过程中用到的仪器是:托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,其中用到的2种定量仪器是托盘天平和500mL容量瓶,故答案为:6.3;500mL容量瓶;
(4)若要探究K+对该反应有无催化作用,必须保持其他的影响因素如H2C2O4的浓度、KMnO4的浓度以及稀硫酸的浓度与实验1是相同的,而H2C2O4、KMnO4以及稀硫酸的加入的物质的量相同,故若使浓度相同,则必须溶液体积与实验1相同,故加入的水的体积X=25mL,根据溶液褪色的时间可以看出,Mn2+对该反应有催化作用,导致反应速率加快,溶液褪色的时间缩短,故假设2是成立的,
故答案为:25;2.
点评 本题考查元素化合价的判断、对图象的分析处理以及温度、催化剂对反应速率的影响、氧化还原反应滴定的有关计算,综合性较强,难度适中.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
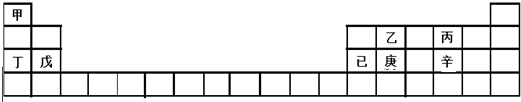
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 | |
| B. | 乙烷(乙烯):用溴水洗气 | |
| C. | 溴苯(溴):用NaOH溶液洗涤后分液 | |
| D. | 乙醇(水):用生石灰吸水后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com