
化学与生产、生活密切相关,下列说法错误的是
A.Cl2、ClO2、漂白粉都可用于自来水的杀菌消毒
B.CO2、CH4气体的大量排放会造成温室效应的加剧
C.化石燃料的直接利用,促进了“低碳”经济的发展
D.市售的加钙盐、加碘盐,这里的“钙”、“碘”指的是元素
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
下列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2===CH—CH===CH2的事实是 ( )
A.燃烧有浓烟
B.能使酸性KMnO4溶液褪色
C.能与溴发生1∶2加成反应
D.与足量溴水反应,生成物中只有2个碳原子上有溴原子
查看答案和解析>>
科目:高中化学 来源: 题型:
以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥浓硫酸不慎洒到皮肤上,先用大量水冲洗后再涂上NaHCO3溶液
⑦碱流到桌子上,先加稀醋酸溶液中和,后用水冲洗
A.①②③⑤⑦ B.①②④⑤⑥
C.①②③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,则下列说法正确的是
A.15g甲基(-CH3)所含有的电子数是9NA
B.常温常压下,0.1mol甲烷与甲醛混合气体中所含碳原子数为0.1NA
C.标准状况下,1L庚烷充分燃烧后生成的气态产物的分子数为7/22.4 NA
D.常温常压下, 1mol苯分子中含有碳碳双键数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: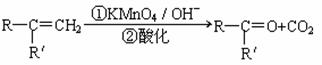
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
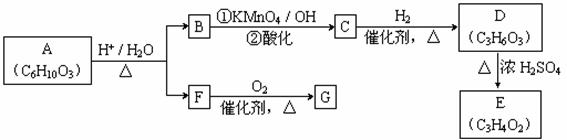
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是_______,名称是______。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________ _________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是: [ ____________ _________、________ ____________。
(5)A转化为B和F的化学方程式是
_________ _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是
A.CaO、H2O、C2H5OH均为氧化物
B.H2SO4、H3PO4、HNO3均为酸
C.Ca(OH)2、Cu2(OH)2CO3均为碱
D.空气、CuSO4·5H2O、碘酒均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
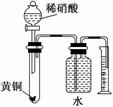
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物对人类现代文明具有特殊贡献,请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚 ④普通玻璃 ⑤硅太阳能电池
A.①②③ B.③④⑤
C.②③④ D.①③④
(3)常温下,SiCl4为液态,沸点为57.6℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度S iCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:_______________________________________。
iCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:_______________________________________。
(4)工业上可用SiCl4(g)制备高温结构陶瓷氮化硅,其反应方程式为
 3SiCl4(g)+2N2(g)+6H2(g)
3SiCl4(g)+2N2(g)+6H2(g)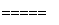 Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
①该反应的平衡常数表达式K=______________.
②在密闭恒容容器中,能表示上述反应达到平衡状态的是_______ _。
_。
A.3v逆(N2)=v正(H2)
B.v正(HCl=4v正=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
③在某条件下达到平衡时,H2与HCl物质的量之比为m∶n;保持其他条件不变,降低温度达到平衡时,H2与HCl物质的量之比________m∶n(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com