
| A. | 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发 | |
| B. | 蒸馏操作中冷凝管的冷却水应下进上出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 浓硫酸的稀释可以在量筒中进行 |
分析 A.蒸发时,利用余热加热;
B.蒸馏时冷水下进上出,冷却效果好;
C.分液时避免上下层液体混合;
D.稀释浓硫酸在烧杯中进行.
解答 解:A.蒸发时,利用余热加热,则蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发,故A正确;
B.蒸馏时冷水下进上出,冷却效果好,则蒸馏操作中冷凝管的冷却水应下进上出,故B正确;
C.分液时避免上下层液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.稀释浓硫酸在烧杯中进行,量筒只能用于量取液体的体积,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 | |
| D. | 乙酸溶于水可以电离,属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、硫酸铜、硫酸 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、石灰水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 25℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;2组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 35℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 35℃ | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/L KOH溶液,观察现象. | 若蓝色不褪色,则假设二正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中使用的漂白粉和肥皂都是混合物 | |
| B. | 烟、雾、豆浆、有色玻璃都是胶体 | |
| C. | 汽油属于混合物,而液氯、冰醋酸均属于纯净物 | |
| D. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
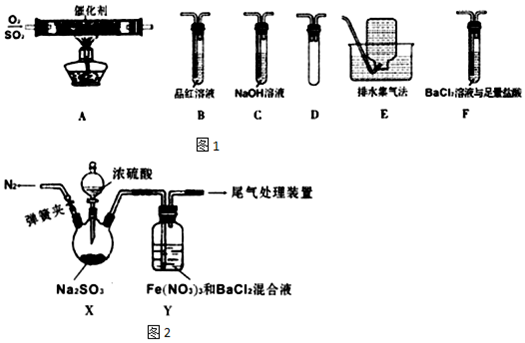
| 实验步骤 | 现象和结论 |
| ①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的稀硝酸与BaCl2的混合液,并通入适量N2; ③将SO2通入步骤②中溶液. | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com