
A.溶液的pH升高 B.同温、同压下两极上析出等体积的气体
C.阴极质量增加 D.溶液中c(Cl-)几乎不变
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
(12分)工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省启东中学高三上学期第二次月考化学试卷 题型:填空题
(12分)工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: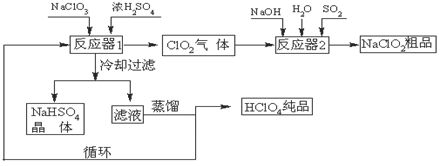
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期第二次月考化学试卷 题型:填空题
(12分)工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
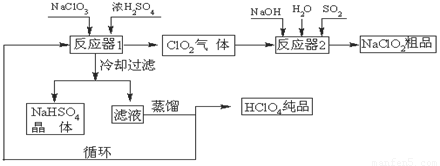
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
查看答案和解析>>
科目:高中化学 来源:江苏月考题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com