
【题目】下列物质不能做还原剂的是:
A. H2S B. Fe2+ C. F2 D. SO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
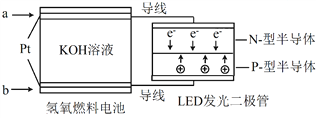
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某周期ⅡA族元素的原子序数为 x,则同周期的第ⅢA族元素的原子序数是( )
A.只有 x+1
B.可能是 x+8或 x+18
C.可能是 x+2
D.可能是 x+1或 x+11或x+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,工业上合成尿素(H2NCONH2)的反应如下:2NH3(I)+CO2(g)H2O(I)+H2NCONH2(I)△H=﹣103.7kJmol﹣1试回答下列问题:
(1)写出一种有利于提高尿素的产率的措施是 .
(2)合成尿素的反应在进行时分为如下两步: 第一步:2NH3(I)+CO2(g)H2NCOONH4(I)(氨基甲酸铵)△H1
第二步:H2NCOONH4(I)H2O(I)+H2NCONH2(I)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.2L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图甲所示:
①●●代表的物质为(填化学式)
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,反应进行到10min时到达平衡.反应进行到10min时测得●●所代表的物质的量如图所示,则该物质表示的表示化学反应的速率为molL﹣1min.L﹣1
③第二步反应的平衡常数K2随温度的变化如乙图所示,则△H1 0 (填“>”“<”或“=”).
④第一步反应在(填“较高”或“较低”)温度下有利该反应自发进行.
(3)已知: N2(g)+O2(g)=2NO(g)△H=+180.6kJmol﹣1
N2(g)+3H2(g)=2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是( )
A. N2 B. N2O3 C. HNO3 D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.酒精、冰醋酸、纯碱均为电解质B.硅酸、稀豆浆、氯化铁溶液均为胶体
C.碘酒、食盐水、氨水均为混合物D.SO2、SiO2、CO均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚 ![]() 是生漆的主要成分,黄色,能溶于有机溶剂.生漆涂在物体表面能在空气中干燥而转变为黑色漆膜.下列关于漆酚说法错误的是( )
是生漆的主要成分,黄色,能溶于有机溶剂.生漆涂在物体表面能在空气中干燥而转变为黑色漆膜.下列关于漆酚说法错误的是( )
A.可以燃烧,当氧气充分时,产物为CO2和H2O
B.与FeCl3溶液发生显色反应
C.能发生取代反应和加成反应
D.不能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置模拟工业生产制备少量硝酸。

(1)装置 A 的作用是________, NaOH 溶液的作用是 _________________________。
(2)化学实验室制氨气化学方程式为__________。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到 700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)_____________。

(4)在微电子工业中,氨气的水溶液可作刻蚀剂 H2O2 的清除剂,所得产物不污染环境,其化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应的快慢和限度具有十分重要的意义。
回答下列问题:
(1)反应2SO2(g) + O2(g)![]() 2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”), 催化剂对该反应的平衡状态_________影响(“有”或“无”)。
(2)常温下,实验室用100 mL 6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入____(填序号 )。
A.CH3COONa固体 B.KNO3固体
C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是___________________。
(3)一定温度下,在体积固定的密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。图中能够表明起始加入的物质是__________________,反应达平衡的时间是____________,该反应的化学方程式可表示为______________________________;下列说法中能够判定该反应处于平衡状态的是______________填 序号)。

A.容器的压强不再变化
B.气体的颜色不再变化
C.每反应2 mol的N生成1 mol的M
D.气体的密度不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com