
| A. | 纯碱 | B. | 明矾 | C. | 蔗糖 | D. | 火碱 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将饱和FeCl3溶液逐滴加入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | Al(OH)3胶体能使水中的悬浮颗粒沉降,达到净水的目的 | |
| D. | 豆浆、蔗糖溶液均属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
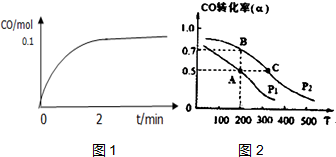 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com