
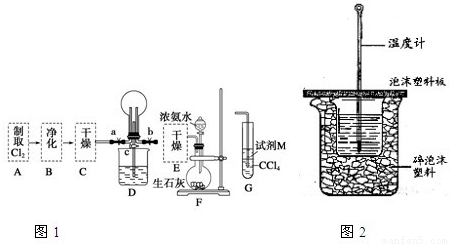
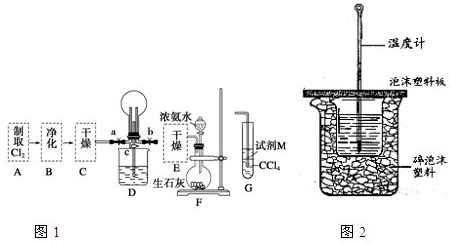
 Mn2++Cl2↑+2H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
Mn2++Cl2↑+2H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,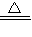 Mn2++Cl2↑+2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
Mn2++Cl2↑+2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;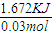 =55.7KJ/mol,故答案为:-55.7kJ?mol-1;
=55.7KJ/mol,故答案为:-55.7kJ?mol-1;

科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
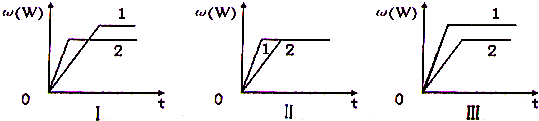
| A、图I可能是不同压强对反应的影响,且p2>p1,a+b<n | B、图II可能是不同压强对反应的影响,且p1>p2,n<a+b | C、图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 | D、图Ⅲ可能是不同温度对反应影响,且T1>T2,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源:南昌模拟 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com