
| A、探究Na在空气中放置后的生成物是Na2CO3 |
| B、探究Na与水反应有O2生成 |
| C、探究含铁元素的营养酱油中的铁以Fe2+或Fe3+的形式存在 |
| D、探究向滴有酚酞的NaOH溶液中通Cl2时,溶液褪色是NaClO的漂白性所致 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、增大CO的浓度 |
| D、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)| A、原AgNO3溶液的物质的量浓度为0.1 mol?L-1 |
| B、图中x点的坐标为(100,6 ) |
| C、图中x点表示溶液中Ag+与Cl-浓度相同 |
| D、把0.1 mol?L-1的NaCl换成0.1 mol?L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
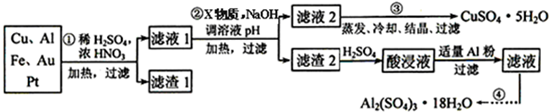
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
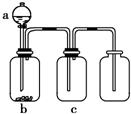 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
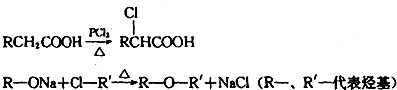
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别取样配成溶液,逐滴滴加盐酸,看气泡产生情况 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com