
| A. | 1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量 |
分析 A、反应放热,反应物能量高;
B、热化学方程式的化学计量数表示物质的量;
C.状态不同反应的焓变不同,放热反应焓变为负值,结合盖斯定律分析判断;
D、热化学方程式的化学计量数只表示物质的量.
解答 解:A、△H<0,反应放热,反应物能量高,故A错误;
B、S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1,热化学方程式的化学计量数表示物质的量,1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量,故B正确;
C、固体硫变化为气体硫吸热,焓变为负值,S(s)+O2(g)=SO2(g)△H>-Q kJ•mol-1 ,故C错误;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数,故D错误;
故选B.
点评 本题考查对热化学方程式的理解,特别是其化学计量数只表示物质的量.题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
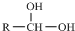 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$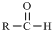 请根据如图回答:
请根据如图回答: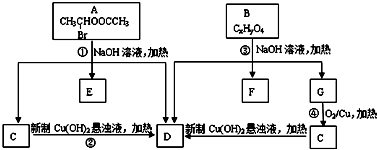
 .
. ;
; .
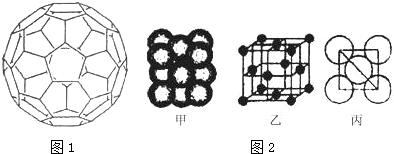
.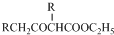 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
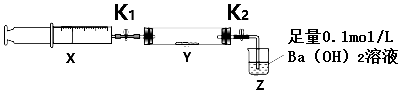
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | ①淡黄色固体变为白色粉末 | ②反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | ③Z中液体出现倒吸 | ④不用解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-与1mol-OH所含质子数均为9NA | |
| B. | 0.1mol/L的CuCl2溶液中含Cl-的数目为0.2 NA | |
| C. | 标准状况下,11.2LCCl4中含C-C键的数目为2NA | |
| D. | 10 mL 2mol/LH2O2完全分解,转移的电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离乙醇与油脂的混合物 | |
| B. | 用玻璃棒蘸取次氯酸溶液点在干燥的pH试纸中部,测定次氯酸溶液的pH | |
| C. | 在含FeCl3杂质的MgCl2溶液中加入适量的MgCO3,微热,充分搅拌,静置,过滤得较纯净的MgCl2溶液 | |
| D. | 将甲烷与氯气按物质的量之比1:2通入烧瓶,光照,制取纯净的CH2Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com