
| A. | 两原子,如果核外电子数相同,则一定属于同种元素 | |
| B. | 两种微粒,若核外电子数相同,则其化学性质一定相同 | |
| C. | 在多电子的原子里不同电子层的核外电子的能量是不相同的 | |
| D. | 能量低的电子在离核近的区域运动 |
分析 A.具有相同质子数的原子属于同一种元素;
B.核外电子数相同的两种微粒不一定为同一种元素;
C.不同电子层的核外电子的能量不同;
D.根据原子核外电子的排布规律判断.
解答 解:A.具有相同质子数的原子属于同一种元素,核外电子排布也相同,故A正确;
B.核外电子数相同的两种微粒不一定为同一种元素,如OH-、Na+性质不同,故B错误;
C.不同电子层的核外电子的能量不同,故C正确;
D.原子核外电子的能量不同,能量低的在离核近的区域运动,能量高的在离核远的区域运动,故D正确.
故选B.
点评 本题考查原子结构和元素的性质,为高频考点,侧重于双基的考查,题目难度不大,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 水果、蔬菜 | B. | 米饭、面条 | C. | 瘦肉、鸡蛋 | D. | 奶油、牛油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.
(1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
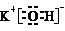 ;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.
;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b、d、e | B. | b、c、e、f | C. | a、b、c | D. | b、c、d、e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com