
| A�����ˮ | B��п��ϡ���ᷴӦ |
| C����⺣ˮ | D����ʯ�͡���Ȼ��Ϊԭ�� |
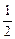 O2(g)===H2O(l) ��H=��285.8 kJ��mol��1
O2(g)===H2O(l) ��H=��285.8 kJ��mol��1
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��ֻ���������ڵ�����ԭ��֮�� |
| B��ʧ�����ѵ�ԭ�ӻ�õ��ӵ�����һ��ǿ |
| C���ڻ�ѧ��Ӧ�У�ijԪ���ɻ���̬��Ϊ����̬�����Ԫ��һ������ԭ |
| D�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�࣬���Ӱ뾶ԽС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������������ȼ�� | B����˿��������ȼ�� |
| C������������ȼ�� | D����̿�ڸ�������ˮ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��NH3(g)+HCl(g) NH4Cl(s) NH4Cl(s) | B��CaCO3(s) CaO(s)��CO2(g) CaO(s)��CO2(g) |
C��4Al(s)��3O2(g) 2Al2O3(s) 2Al2O3(s) | D��HCl(aq)��NaOH(aq) NaCl(aq)��H2O(l) NaCl(aq)��H2O(l) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ʯȼ�Ϻ�ֲ��ȼ��ȼ��ʱ�ų�����������Դ��̫���� |
| B�����������������ǵ���ת��Ϊ��ѧ�ܵĹ��� |
| C��CO(g)��ȼ������283.0kJ/mol����2CO2(g)===2CO(g)��O2(g)��Ӧ�ġ�H��+2��283.0kJ/mol |
| D�����ȷ�Ӧһ�������ȷ�Ӧ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(s) =
C(s) =  CO2(g) + 2 Fe(s) ����="234.1" kJ��mol-1
CO2(g) + 2 Fe(s) ����="234.1" kJ��mol-1 O2(g) = Fe2O3(s) ��������
O2(g) = Fe2O3(s) ��������| A��-824.4 kJ��mol-1 | B��-627.6 kJ��mol-1 |
| C��-744.7 kJ��mol-1 | D��-169.4 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڢ� | B���ڢۢ� | C���٢ۢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 O2(g)��H2O(l) ��H 3����285.8kJ/mol
O2(g)��H2O(l) ��H 3����285.8kJ/mol | A��488.3 kJ/mol | B����488.3 kJ/mol | C����244.15 kJ/mol | D��244.15 kJ/mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com