
100 g碳燃烧所得气体中,CO占1/3 体积,CO2占 2/3 体积,且C(s)+ 1/2 O2(g)====CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+  O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92 kJ B.2 489.44 kJ C.784.92 kJ D.3 274.3 kJ
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2014-2015学年甘肃省天水市高二上学期期中考试化学试卷(解析版) 题型:选择题
0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是
A、CH4 B、C2H4 C、C3H6 D、C6H6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:实验题
(每空2分,共12分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
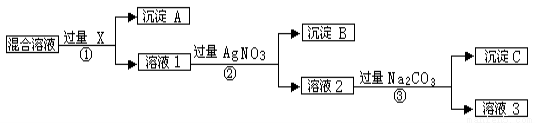
请回答下列问题:
(1)写出实验流程中下列物质的化学式: 试剂X : ,沉淀A: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和④ C.③和④ D.①和③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:填空题
(15分) 用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下: 3SiCl4(g)+2N2(g)+6H2(g)  Si3N4(s)+12HCl(g)( △H<0) 完成下列填空:
Si3N4(s)+12HCl(g)( △H<0) 完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加 了2.80 g,则H2的平均反应速率 mol/(L·min);该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比 (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)  nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
已知298 K时,合成氨反应N2(g)+3H2(g)?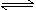 2NH3(g) ΔH=-92.0 kJ·mol-1,将此
2NH3(g) ΔH=-92.0 kJ·mol-1,将此
温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反
应放出的热量为(假定测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况)
B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com