
��8�֣����з�Ӧ��210��ʱ�ﵽƽ�⣺
��PCl5��g�� PCl3��g��+Cl2��g������H1>0
K1=1mol��L��1
PCl3��g��+Cl2��g������H1>0
K1=1mol��L��1
��CO��g��+Cl2��g�� COCl2��g������H2<0
K2=5��104L��mol��1
COCl2��g������H2<0
K2=5��104L��mol��1
��COCl2��g�� CO��g��+Cl2��g�� ��H3
K3
CO��g��+Cl2��g�� ��H3
K3
��2SO2��g��+O2��g�� 2SO3��g������H4<0
2SO3��g������H4<0
��1����Ӧ�۵�ƽ�ⳣ��K3Ϊ ��
��2��Ҫʹ��Ӧ�ٺͷ�Ӧ�ڵ�K��ֵ��ȣ��ɲ�ȡ�Ĵ�ʩ�� ������ţ���
A�����ͷ�Ӧ�١�����ϵ��Cl2Ũ�� B����Ӧ�١���ѡ��ͬ�Ĵ���
C����Ӧ�١���Ӧ��ͬʱ�����¶� D����Ӧ�١���Ӧ��ͬʱ�����¶�
E����Ӧ�ٽ����¶ȣ���Ӧ��ά��210��
��3���ڼס����������зֱ�����Ӧ�ܣ����ݡ��Һ�ѹ���¶���ͬ�Һ㶨����ʼʱ���м���0.02molSO2��0.01molO2�����м���0.02molSO3���壬��ʼʱ������ѹǿ��ȣ����ֱ�ﵽƽ�⡣�����й����Ǵﵽƽ��״̬���������ȷ���� ������ţ���
A�����������С���� B��SO3�����ʵ�������һ��С����
C��ѹǿ�����ܴ����� D��Ũ�ȱ�c(SO2)/c(SO3)����һ��С����
��4��������Ϊ�ݻ�����ķ�Ӧ������Ҫ��ͨ��������ϵ���¶�ʹ��Ӧ�ܴﵽƽ��ʱ���������������������ʵ���Ϊ15mol�����������м���xmolSO2��6.5mol O2��2.0molSO3��
����x=5.5����Ҫ ������͡������ߡ����֡�����ϵ�¶ȣ�ʹ��Ӧ��ƽ��ʱ�ﵽ����Ҫ��
����ʹ��ʼ��Ӧά�����淴Ӧ�����ƶ�����x��ȡֵ��ΧΪ ��
����8�֣�
��1��K3 = 2��10-5 mol��L-1 ��2��C ��1�֣�
��3��B ��1�֣� ��4�� ������ ��2�֣� ��5.5< x <6.5
����������1�� K3=1/ K2 ��2��Ҫע��Kֵֻ���¶��йأ������ų�ABѡ�����D�ͬʱ���£�K1��С��K2�����������⣬��C��ȫ��ȷ��
��3���������ڴﵽƽ��ǰ�൱�ڼ�ѹ��
��4������x=5.5�����ʼ״̬��Ӧ���������ʵ���֮��Ϊ14 mol��Ϊ�˴ﵽƽ��ʱҪ���15mol����ӦӦ�����淴Ӧ�����ƶ����������¶ȡ�
����ƽ������,SO3ȫ��ת��Ϊ��Ӧ����������:2.0+x+6.5+2/2=15,x=5.5������Ϊ��ʹ��ʼ��Ӧ��������У���x+6.5+2<15����x<6.5,����5.5< x <6.5



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣����з�Ӧ��210��ʱ�ﵽƽ�⣺
��PCl5��g��PCl3��g��+Cl2��g������H1>0 K1=1mol��L��1
��CO��g��+Cl2��g��COCl2��g������H2<0 K2=5��104L��mol��1
��COCl2��g�� CO��g��+Cl2��g�� ��H3 K3
��2SO2��g��+O2��g��2SO3��g������H4<0
��1����Ӧ�۵�ƽ�ⳣ��K3Ϊ ��
��2��Ҫʹ��Ӧ�ٺͷ�Ӧ�ڵ�K��ֵ��ȣ��ɲ�ȡ�Ĵ�ʩ�� ������ţ���
A�����ͷ�Ӧ�١�����ϵ��Cl2Ũ�� B����Ӧ�١���ѡ��ͬ�Ĵ���
C����Ӧ�١���Ӧ��ͬʱ�����¶� D����Ӧ�١���Ӧ��ͬʱ�����¶�
E����Ӧ�ٽ����¶ȣ���Ӧ��ά��210��
��3���ڼס����������зֱ�����Ӧ�ܣ����ݡ��Һ�ѹ���¶���ͬ�Һ㶨����ʼʱ���м���0.02molSO2��0.01molO2�����м���0.02molSO3���壬��ʼʱ������ѹǿ��ȣ����ֱ�ﵽƽ�⡣�����й����Ǵﵽƽ��״̬���������ȷ���� ������ţ���
A�����������С���� B��SO3�����ʵ�������һ��С����
C��ѹǿ�����ܴ����� D��Ũ�ȱ�c(SO2)/c(SO3)����һ��С����
��4��������Ϊ�ݻ�����ķ�Ӧ������Ҫ��ͨ��������ϵ���¶�ʹ��Ӧ�ܴﵽƽ��ʱ���������������������ʵ���Ϊ15mol�����������м���xmolSO2��6.5mol O2��2.0molSO3��
����x=5.5����Ҫ ������͡������ߡ����֡�����ϵ�¶ȣ�ʹ��Ӧ��ƽ��ʱ�ﵽ����Ҫ��
����ʹ��ʼ��Ӧά�����淴Ӧ�����ƶ�����x��ȡֵ��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�긣��ʡ�����и߶���ѧ��������⻯ѧ���� ���ͣ������
��6�֣����з�Ӧ��210��ʱ�� ��ƽ�⣺
��ƽ�⣺
��PCl5��g��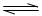 PCl3��g��+C12��g�� ��H1>0 K1="1" mol��L��1
PCl3��g��+C12��g�� ��H1>0 K1="1" mol��L��1
��CO��g��+C12��g��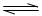 COCl2��g�� ��H2<O K2=5��104 mol��L��1
COCl2��g�� ��H2<O K2=5��104 mol��L��1
��COCl2��g��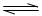 CO��g��+Cl2��g�� K3=?
CO��g��+Cl2��g�� K3=?
��2SO2��g��+O2��g��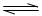 2SO3��g�� ��H4<0
2SO3��g�� ��H4<0
��1����Ӧ�۵�ƽ�ⳣ��K3Ϊ  ��
��
��2��Ҫʹ��Ӧ�ٺͷ�Ӧ�ڵ�K��ֵ��ȣ��ɲ�ȡ�Ĵ�ʩ�� ������ţ���ͬ����
A�����ͷ�Ӧ�١�����ϵ��Cl2Ũ��
B����Ӧ�ٽ����¶ȣ���Ӧ��ά��210��
C����Ӧ�١���Ӧ��ͬʱ�����¶�
��3����ʹ��Ӧ�����������ƶ����ɲ�ȡ�Ĵ�ʩ��
A������������������� B������SO3�����ʵ���
C����ѹ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com