
| A. | 在原电池的负极和电解池的阳极上发生的都是氧化反应 | |
| B. | 实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为1:1 | |
| C. | 一定条件下可能发生反应:Cu+H2SO4═CuSO4+H2↑ | |
| D. | 在用惰性电极电解稀硫酸的过程中,溶液pH保持不变. |
分析 A、工作时,原电池的负极上失电子,电解池的阳极上失去电子;
B、根据电解方程式中氢气和氯气的关系式判断其体积比;
C、铜是活泼电极,用铜作电极电解稀硫酸溶液时,阳极上铜放电,阴极上氢离子放电;
D、用惰性电极电解稀硫酸的过程中,阳极上析出氧气,阴极上析出氢气,实则电解水,溶液的溶质不变,溶剂改变,据此确定溶液浓度的变化来判断pH的变化.
解答 解:A、工作时,原电池的负极上失电子发生氧化反应,电解池的阳极上得电子发生氧化反应,故A正确;
B、用惰性电极电解NaCl溶液的电解方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,根据方程式知,氢气和氯气的体积之比为1:1,故B正确;
C、用铜作电极电解稀硫酸,刚开始时,阳极上铜失电子,阴极上氢离子得电子,所以可能发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑,故C正确;
D、用惰性电极电解稀硫酸的过程中,阳极上析出氧气,阴极上析出氢气,实则电解水,溶液的溶质不变,溶剂的量减少,导致溶液中氢离子浓度增大,pH减小,故D错误.
故选D.
点评 本题考查了原电池和电解池原理,注意活泼金属作电极电解电解质溶液时,阳极上是电极材料失电子而不是溶液中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:实验题
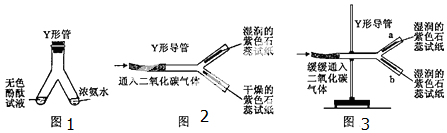
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2中N的化合价为+5价 | B. | 生成1molN2时转移的电子数是6mol | ||
| C. | NH4Cl中N元素被还原 | D. | N2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
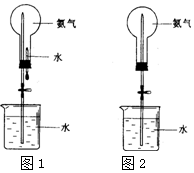 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
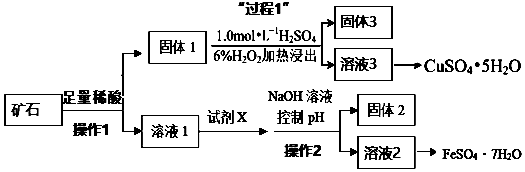
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C互称同位素,O2与O3是氧元素的同素异形体 | |
| B. | SO2和SO3属于酸性氧化物,Na2O和Na2O2属于碱性氧化物 | |
| C. | 潮解和电解属于化学变化,蒸馏和干馏属于物理变化 | |
| D. | 沼气和水煤气属于可再生能源,锌锰干电池和铅蓄电池属于二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
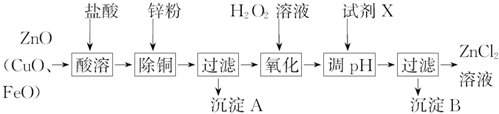
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
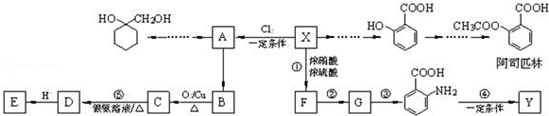
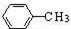 $\stackrel{MnO(H)}{→}$
$\stackrel{MnO(H)}{→}$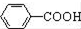
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$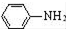 (苯胺,易被氧化)
(苯胺,易被氧化) .
.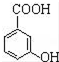 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: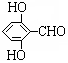 、
、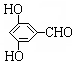 .
.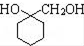 的流程图:
的流程图: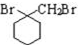 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$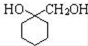
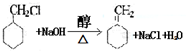 .
.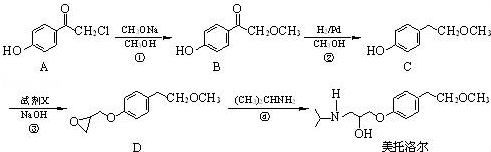
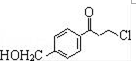 为原料制备
为原料制备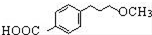 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com