
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:阅读理解
| +4 |
| S |
| +6 |
| S |

| 3.16nv |
| m |
| 3.16nv |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Mn(OH)2+
Mn(OH)2+ O2--H2MnO3
O2--H2MnO3 MnMnO3+
MnMnO3+ H2SO4+
H2SO4+ KI---
KI--- MnSO4+
MnSO4+ I2+
I2+ H2O+
H2O+ K2SO4
K2SO4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
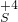 →
→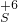 转化
转化
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| +4 |
| S |
| +6 |
| S |
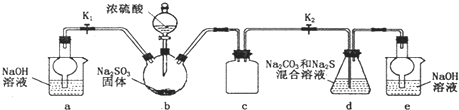
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省南平市光泽二中高二(下)期末化学试卷(解析版) 题型:解答题
 →
→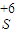 转化
转化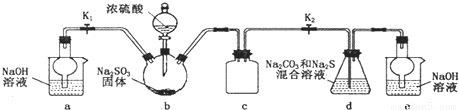
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com