
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是( )
A B
C D
科目:高中化学 来源: 题型:阅读理解
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:宁夏银川二中2011届高三第三次月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
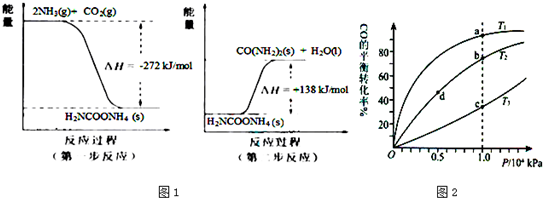
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
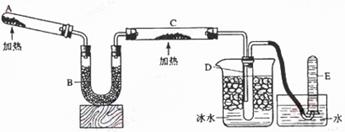
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com