
【题目】下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有 ( )
A.CO、O2、CH4B.HCl、Cl2、CO2C.H2、CO、NO2D.SO2、Cl2、O2
科目:高中化学 来源: 题型:
【题目】已知有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L。
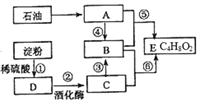
(1)淀粉的分子式为_______; D中的官能团名称为_______。
(2)简述检验反应①有D生成的实验方法:_____。
(3)物质B、C、E可以用 _______(填写试剂名称)鉴别。
(4)反应⑤的化学方程式为________。
(5)写出反应⑥的化学方程式并标注B、C断裂的化学键部位____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为 _____ 。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 ____ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:
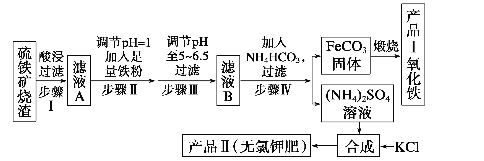
回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ____ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为______ 。
(3)写出步骤Ⅳ反应的离子方程式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)⑧的气态氢化物为_________(填电子式)
(2)⑤对应的碱为_____(填电子式);③的最高价含氧酸_____(填化学式)。
(3)比较⑤、⑥元素的金属性强弱________;并写出它们最高价氧化物的水化物反应的化学方程式__________。
(4)写出一种由原子序数①、③、⑧三种元素组成化合物的化学式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阴离子和阳离子都为稀有气体元素原子结构,且阳离子比阴离子少两个电子层的离子化合物是( )
A. MgCl2B. BaF2C. NaBrD. NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2和HNO3溶液反应生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验

(1)仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):

已知:Ⅰ. 
Ⅱ. 
回答下列问题
(1)B的名称是______________。
(2)反应②和⑤所属的反应类型分别为____________、______。
(3)反应④所需的条件为___________,E分子中官能团的名称为_________________。
(4)反应⑥的化学方程式为________________________________。
(5)芳香族化合物X是C的同分异构体,X只含一种官能团且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,则X的结构有__________种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的结构简式为____________、_____________。
(6)写出以乙醇和甲苯为原料制备 的路线(其他无机试剂任选)_________________。
的路线(其他无机试剂任选)_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com