
| A. | 热稳定性:X2R>X2Y | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z位于第三周期第ⅢA族,Z与Y形成的化合物是一种比较好的耐火材料 | |
| D. | 使甲基橙变红色的溶液中:K+、R2-、ZY2-、WY32- 一定能大量共存 |
分析 X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素,R与Y处于同一族,R应为S元素,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,Z应为Al元素,W单质是人类将太阳能转变为电能的常用材料,则W为Si元素;结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素,R与Y处于同一族,R应为S元素,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,Z应为Al元素,W单质是人类将太阳能转变为电能的常用材料,则W为Si元素;
A.元素的非金属性越强,其氢化物越稳定,则热稳定性:H2O>H2S,即热稳定性:X2R<X2Y,故A错误;
B.SiO2能与碱反应,也能与HF反应,故B错误;
C.Al位于第三周期第ⅢA族,Al与O形成的化合物氧化铝的熔点很高,是一种比较好的耐火材料,故C正确;
D.使甲基橙变红色的溶液中,说明含有氢离子,则S2-、AlO2-、CO32- 不能大量共存,故D错误.
故选C.
点评 本题考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意把握原子结构特征和对应单质、化合物的性质,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
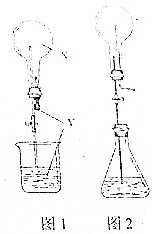 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
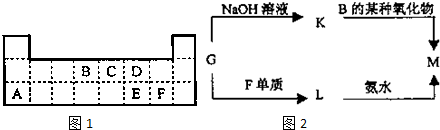
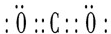 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| B. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 | |
| C. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com