
| A. | AgCl(Ksp=1.56×10-10) | B. | Ag2CO3(Ksp=8.1×10-12) | ||
| C. | Ag2CrO4(Ksp=9.0×10-12) | D. | AgBr(Ksp=5.0×10-13) |
分析 根据对应化学式相似的AgCl和AgBr来说Ksp越小Ag+浓度越小,即AgCl>AgBr;同理:Ag2CrO4>Ag2CO3,
AgCl溶液中c(Ag+)=$\sqrt{1.56×1{0}^{-10}}$mol/L,
假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=9.0×10-12,x3=1.8×10-11,即x=$\root{3}{1.8×1{0}^{-11}}$≈3×10-4,以此比较Ag+浓度大小.
解答 解:根据对应化学式相似的AgCl和AgBr来说Ksp越小Ag+浓度越小,即AgCl>AgBr;同理:Ag2CrO4>Ag2CO3;
假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=9.0×10-12,x3=1.8×10-11,即x=$\root{3}{1.8×1{0}^{-11}}$≈3×10-4,
AgCl饱和溶液中Ag+的浓度为$\sqrt{1.56×1{0}^{-10}}$≈1.2×10-5,
所以Ag2CrO4溶液中Ag+浓度较大,
故选C.
点评 本题主要考查溶度积常数的概念和有关计算,侧重于学生的分析、计算能力的考查,做题时注意不同物质的化学式是否相似,如不同,可用溶度积常数计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉与稀硫酸不反应,但加入一定量硝酸钠后铜粉会发生溶解 | |
| B. | 金属Na久置于空气中最终产物是生成Na2O2 | |
| C. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉有红棕色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的分子式为C8H10 | B. | 与苯乙烯是同分异构体 | ||
| C. | 能发生加成反应 | D. | 它的二氯代物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
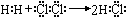 ;
;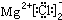 ,
,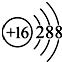
| A. | ①②③④⑤ | B. | ④⑤ | C. | ③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=乙=丙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com