
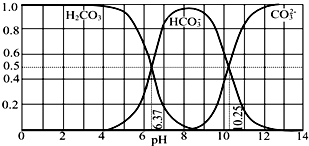
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
分析 A.根据图示可知,pH=10.25时溶质为碳酸钠和碳酸氢钠,根据物料守恒判断;
B.根据图示可知,pH在7~9之间主要存在碳酸氢根离子;
C.根据pH=6.37时碳酸氢根离子和碳酸的浓度相等计算;
D.pH=10时溶液呈碱性,则c(OH-)>c(H+),c(Na+)离子浓度最大,结合图象曲线变化可判断c(HCO3-)、c(CO32-)的大小.
解答 解:A.pH=10.25时,溶质为碳酸钠和碳酸氢钠,碳酸钠溶液中满足物料守恒:c(Na+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3),碳酸氢钠溶液中存在物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),则混合液中c(Na+)>c(CO32-)+c(HCO3-),故A错误;
B.根据图示可知,pH在7~9之间,溶液中主要存在HCO3-,该pH范围内和获得较纯的NaHCO3,故B正确;
C.根据图象曲线可知,pH=6.37时,H2CO3和HCO3-的浓度相等,碳酸的第一步电离的平衡常数K1(H2CO3)=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$=10-6.37,故C正确;
D.pH=10时的溶液为碱性,则c(OH-)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)离子浓度最大,结合图象曲线变化可知:c(HCO3-)>c(CO32-),此时离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D正确;
故选A.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小的中的应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 溶液中加入盐酸,再滴加BaCl2溶液 | 先无现象,后产生白色沉淀 | 原溶液中有SO42- |
| B | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Mg电极溶解 | Mg比Al金属活动性强 |
| D | 向稀HNO3溶液中加入过量铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | 和HNO3具有氧化性,能将Fe氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
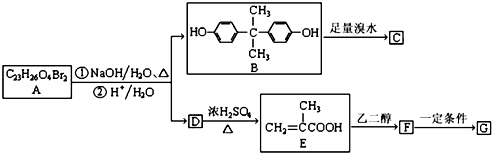
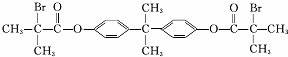
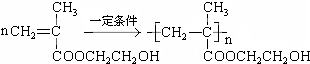 .
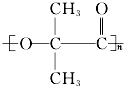
.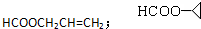 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 汽油、柴油和植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| C. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
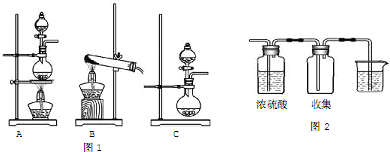
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
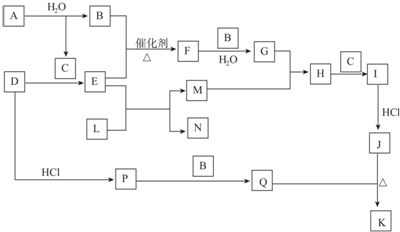
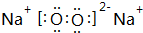 ,D的化学式(NH4)2S.
,D的化学式(NH4)2S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com