
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.25 ℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA
B.1 mol苯乙烯( )中含有的碳碳双键数为4NA
)中含有的碳碳双键数为4NA
C.加热条件下,4.6 g金属Na与足量O2反应的产物中阳离子和阴离子总数为0.3NA
D.常温时,1 L 0.1 mol·L-1的硝酸铵溶液中,NH4+和H+总数为0.1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高一上12月月考化学试卷(解析版) 题型:选择题
某有机物分子中有 n 个-CH 2 -, m 个 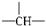 ,a个-CH 3 ,其余为-OH,则该物质分子中OH的个数可能为
,a个-CH 3 ,其余为-OH,则该物质分子中OH的个数可能为
A.m-a B.n+m+a C.m+1-a D.m+2-a
查看答案和解析>>
科目:高中化学 来源:2016届广东省顺德市高三上第四次月考理综化学试卷(解析版) 题型:填空题
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=___;△H___0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_____.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=_____.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是_____;生成1mol K2FeO4转移电子的物质的量是_____mol.
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.0~2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡时v(正)< v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
查看答案和解析>>
科目:高中化学 来源:2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
实验是化学研究的基础。下列关于各实验装置的叙述正确的是
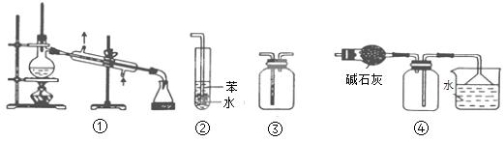
A.装置③可用于收集H2、CO2、Cl2、NH3等气体
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置①常用于分离互不相溶的液体混合物
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:选择题
下列物质既能跟盐酸反应,又能跟NaOH溶液反应的是
①SiO2 ②Al ③Al2O3 ④Al(OH)3
⑤Na2CO3溶液 ⑥Ca(HCO3)2溶液 ⑦NH4HCO3溶液 ⑧KHSO4溶液
A.④⑥⑦⑧ B.②③④⑥⑦ C.①②③④⑦ D.②③④⑤⑧
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
将一定量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩有m1g 铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g ,则(m1-m2)为
A.5.76 B.2.88 C.1.92 D.0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:填空题
要求回答下列问题:
(1)某温度时 NaHCO3 溶液pH=8,则三种含碳元素粒子由大到小的顺序为:__________。
①CO32- ②HCO3- ③H2CO3
等物质的量浓度的Na2CO3和KHCO3混合溶液中各离子浓度由大到小的顺序为 。在Na2CO3和NaHCO3混合液中滴加盐酸至溶液呈中性时,溶质成分为__________________。
(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是_ (填序号)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中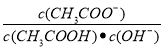 不变
不变
D溶液中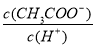 减小
减小
(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=_ (溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是_ (填序号)。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4) 已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:某温度下,向0.1 mol·L-1的NaHA酸性溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
H++A2-。回答以下问题:某温度下,向0.1 mol·L-1的NaHA酸性溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二普通班上期中化学试卷(解析版) 题型:选择题
25℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中,c(NH4+)与c(SO42﹣)之比是( )
A.等于2:1 B.大于2:1 C.小于2:1 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com