(2012?南京模拟)“氢能”将是未来最理想的新能源.
(1)实验测得,1g H
2(g)燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
.
(2)某化学家根据“原子经济”的思想,设计了如下制备H
2的反应步骤
①CaBr
2+H
2O
CaO+2HBr ②2HBr+Hg
HgBr
2+H
2③HgBr
2+
CaO
CaO
HgO
HgO
+
CaBr2
CaBr2
④2HgO
2Hg+O
2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式
.
根据“绿色化学”的思想评估该方法制H
2的主要缺点
循环过程需要很高的能量,且使用重金属汞,产生污染
循环过程需要很高的能量,且使用重金属汞,产生污染
.
(3)氢气通常用生产水煤气的方法制得.其中:CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
小于
小于
1(填“大于”、“小于”或“等于”).
②850℃时,若向一容积可变的密闭容器中同时充入 1.0mol CO、3.0mol H
2O、1.0mol CO
2 和x mol H
2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
0≤x<3
0≤x<3
.
(4)工业生产中,常用氢氧化钠溶液吸收排放废气中的二氧化硫,并将吸收产物电解,可以产生氢气、
硫酸等物质,装置如图1所示.该电解过程中阳极的电极反应式为
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
.
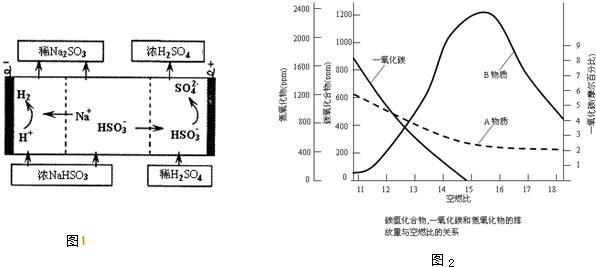
(5)一氧化碳、氮氧化物和碳氢化合物是汽车尾气的主要成分.已知空燃比(空气、燃料体积之比)与尾气中各成分排放量关系如图2所示.B物质的名称是
氮氧化物
氮氧化物
.

![]()
![]()
![]() ②
②![]()
![]()
![]()
![]()
![]()
![]() ④
④![]()
![]()
![]()
![]()
 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑
 2HI+H2SO4
2HI+H2SO4 2HI+H2SO4
2HI+H2SO4