
某元素原子M层电子数比K层电子数多5个,该元素的最高正化合价为( )
|
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
考点:
原子结构与元素的性质.
分析:
某元素的原子M电子层比K电子层多5个电子,根据构造原理,排满L层再排M层,K层2个电子,L层最多为8个电子,则M层为5+2=7个电子,共有17个电子,核电荷数为17,是Cl元素,据此分析.
解答:
解:某元素的原子M电子层比K电子层多5个电子,根据构造原理,排满L层再排M层,K层2个电子,L层最多为8个电子,则M层为5+2=7个电子,共有17个电子,核电荷数为17,是Cl元素,主族最外层电子等于其最高正价,则该元素的最高正化合价为+7;
故选D.
点评:
本题考查结构性质位置关系,比较基础,确定元素是解题关键,注意掌握掌握核外电子排布规律与一些元素的特殊性,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
(1)0.25molH3PO4分子中含有氢原子的物质的量是 ,含有氧原子数目为 .
(2)0.3molH2O与0.4molCO2的物质的量之比为 ,所含分子数目之比为 ,所含氧原子数目之比为 .
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl﹣,则ACl2的摩尔质量是 ,A的相对原子质量是 ,ACl2的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将2mol SO2和2mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2⇌2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量一定大于n mol的是()
A. 2mol SO2+1mol O2
B. 4mol SO2+1mol O2
C. 2mol SO2+1mol O2+2mol SO3
D. 3mol SO2+1mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的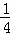 .
.
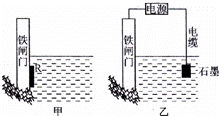
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用如图所示甲的方案,属于 原理(填“原电池”或“电解池”)
(2)图中乙方案也可降低铁闸门腐蚀速率,称为 保护法.
(3)将5mol/L CuSO4溶液200mL用惰性电极电解一段时间后,从其中的一个电极收集到标准状况下448mL气体,为使电解后的溶液恢复到开始的浓度,应向电解后的溶液中加入 物质(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的表示不正确的是( )
|
| A. | S2﹣的结构示意图: | B. | 氯气的电子式:Cl:Cl |
|
| C. | 氧﹣18的原子符号: | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素形成的离子aA+、bB2+、cC﹣、dD2﹣均具有相同的电子层结构,下列判断正确的是( )
|
| A. | 元素的金属性:B>A;元素的非金属性:D>C |
|
| B. | 原子序数:b>a>c>d |
|
| C. | 离子半径:D2﹣>C﹣>B2+>A+ |
|
| D. | 原子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()

A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com