
【题目】燃烧热是指在25℃,101kPa,1mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)=CO2(g) ΔH= -283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8kJ·mol-1
则下列说法正确的是
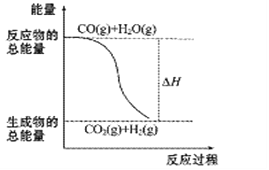
A. H2的燃烧热为241.8 kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l) ΔH> -241.8 kJ·mol-1
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
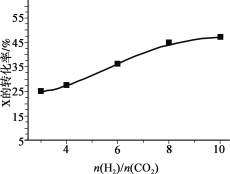
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA
B.常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA
C.4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA
D.2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
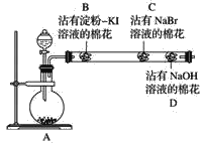
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学合物(F)的合成路线如下:
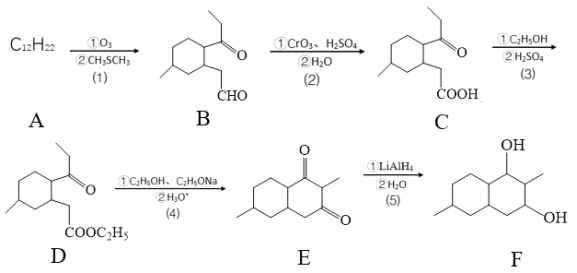
已知: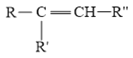
![]()
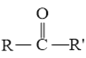 +R″-CHO
+R″-CHO
回答下列问题:
(1)化合物D官能团的名称是_________________。
(2)反应⑸的反应类型是____________。
(3)化合物A的键线式是____________。
(4)化合物B与新制的Cu(OH)2悬浊液反应的化学方程:____________。
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有____个。
(6)芳香化合物G是化合物E的同分异构体,且G满足以下两个条件:
①1molG与足量金属钾反应,在标准状况下放出22.4LH2;
②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1。
则G可能的结构简式____________。
⑺设计由![]() 制备
制备 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图:
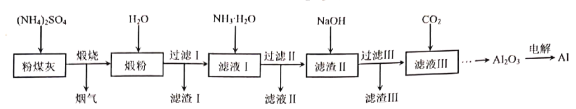
回答下列问题:
(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为___。
(2)“滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为__、__。
(3)将“滤液Ⅱ”通过__、过滤、洗涤、干燥后得到的晶体可返回__工序中循环利用。
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为__。
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为__。
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,则原粉煤灰中铝的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白:
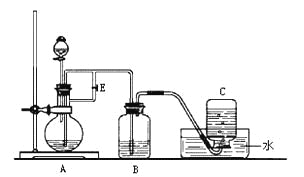
(1)B中盛有一定量的______________,A中应预先加入的试剂是_________,
A中反应的化学方程式为________________________________________。
(2)实验开始时应先将活塞E_______(填“打开”或“关闭”),目的是______________________________________________________________________________。
(3)A反应一段时间后将活塞E_______(填“打开”或“关闭”),目的是____________________________________________________________________________。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为____________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出符合下列要求的离子方程式:
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合_________________;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合____________________;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合____________________;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应______________________________;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com