
下列叙述错误的是( )
A.废弃的干电池不能随意丢弃,但可以土埋处理
B.马口铁(镀锡铁)镀层破损后即失去保护作用
C.不能将铁制自来水管与铜制水龙头连接使用
D.电化学腐蚀过程中存在电极反应,产生微电流
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列化学用语的相关表述正确的是
A. H+(aq)+OH-(aq)=H2O(l) △H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ
B. 因CuSO4·5H2O(s)=CuSO4(s)+5H2O(1) △H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为b kJ
C. 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+c kJ/mol
D. 因N2(g)+3H2(g) 2NH3(g) △H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
2NH3(g) △H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
 把一块镁铝合金投入到20 mL 1 mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1 mol/L的NaO
把一块镁铝合金投入到20 mL 1 mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1 mol/L的NaO H溶液,生成沉淀的物质的量随加入NaOH溶液体积(mL)变化的
H溶液,生成沉淀的物质的量随加入NaOH溶液体积(mL)变化的 关系如图所示。下列说法中正确的是( )
关系如图所示。下列说法中正确的是( )
A.镁铝合金具有很强的抗腐蚀能力,它不溶解在任何酸、碱或盐中
B.c值越大,合金中Al的含量越高
C.b值越大,合金中Mg的含量越高
D.假设c=25,整个反应过程中,主要发生了6个离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述中,合理的是( )
A.将水加热,Kw不变,pH不变
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:K+、H+、Fe2+、NO3-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.含0.1mol·L-1 HCO3-的溶液中:Al3+、Ca2+、NO3-、SO42-
D.含0.1 mol·L-1 SCN-的溶液中:Fe3+、NH4+、NO3-、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各离子浓度的大小比较,正确的是( )
A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl ④ NH3·H2O,
c(NH4+)由大到小的顺序是:① > ③ > ② > ④
B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-)
C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) = c (HCO3-) + c (H+) + c (H2CO3)
D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合:
c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+ 对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是 ( )
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)
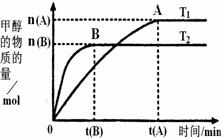 ①温度为T1时,从反应开始到平衡,生成甲醇的
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= 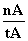 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时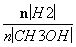 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ( 用 a 表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式
为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com