
��֪��N2(g)+3H2(g) 2NH3(g)��H=" ��92" kJ/mol������������±���һ�������£������Ϊ1L���ܱ������м���1molN2��3molH2��ַ�Ӧ���ų�����Q1kJ������˵����ȷ���ǣ� ��
2NH3(g)��H=" ��92" kJ/mol������������±���һ�������£������Ϊ1L���ܱ������м���1molN2��3molH2��ַ�Ӧ���ų�����Q1kJ������˵����ȷ���ǣ� ��
| | H2(g) | N2(g) | NH3(g) |
| 1mol�����еĻ�ѧ���γ�ʱҪ�ͷų�������/kJ | 436 | 946 | a |
 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д� ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��������ȼ�ϼ�С��Ⱦ���ϡ���ɫ���ˡ�������й���ȼ�ϵ�˵����ȷ����( )
| A������ȼ�����ǽ�ˮ��Ϊ�͵�����ȼ�� |
| B�������Ǿ�����ֵ�ߡ�����Ⱦ���ŵ��ȼ�� |
| C���Ҵ��DZ���������������������ȼ�� |
| D��ʯ�ͺ�ú�ǹ�������ʹ�õĿ������Ļ�ʯȼ��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
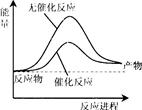
�ݱ�������ѧ�ҿ�����������̫���ֽܷ�ˮ�����ʹ����������й�ˮ�ֽ���̵������仯ʾ��ͼ��ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ˮ������֮Դ��Ҳ�ǻ�ѧ��Ӧ�е����ǡ���ش���������:
������ȼ������Һ̬ˮ�Ȼ�ѧ����ʽ��2H2(g)+O2(g)=2H2O(l) ��H=��572kJ/mol��
(1)�����������ܺ�(����ڡ�����С�ڡ����ڡ�)��Ӧ�������ܺ͡�
(2)��2 mol������ȫȼ������ˮ��������ų������� 572 kJ(�����������������)��
(3)������ֵΪ ��
��������������Ӧ����ˮ������ѧ��ת��Ϊ���ܣ��乹����ͼ��ʾ��a��b�����缫���ɶ��̼����ɡ�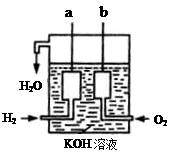
(1)a�缫��Ӧʽ��
(2)b�缫��Ӧʽ��
����ͼ��ʾһ�����ء�X��Y���Ƕ��Ե缫�����Һa�DZ���ʳ��ˮ��ͬʱ�����߸����뼸�η�̪��Һ��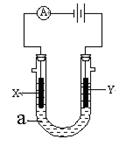
(1��X���ϵĵ缫��ӦʽΪ ��
��X�������۲쵽�������� ��
(2)Y���ϵĵ缫��ӦʽΪ ��
����õ缫��Ӧ����ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ȫȼ��һ����������ˮ�Ҵ����ų�������ΪQ��Ϊ��ȫ�������ɵ�CO2����ʹ֮��������Na2CO3�����ĵ�0.8mol��L NaOH��Һ500mL����ȼ��1mol�ƾ��ų���������
| A��0.2Q | B��0.1Q | C��5Q | D��10Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��20g Ba��OH��2��8H2O������10 g NH4Cl����һ�����С�ձ��У����ձ����ڵ���3��4��ˮ�IJ���Ƭ�ϣ��ò�����Ѹ�ٽ��衣������˵����ȷ����
| A��ʵ���в������������Ǽ��ٹ����ܽ� |
| B������Ƭ�Ͻ������С�ձ�ճ��һ��˵���÷�Ӧ�Ƿ��ȷ�Ӧ |
| C����ȡ��Ӧ�������Ķ��ٻ�Ӱ�췴Ӧ�����ȣ����Ƿ��� |
| D���÷�Ӧ�У���Ӧ���������С��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��(N2H4)�ǻ����������һ��ȼ�ϣ���ӦʱN2O4Ϊ������������N2��ˮ��������֪��
N2(g)+2O2(g)=N2O4(g) ��H="+8.7" kJ��mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H="-534.0" kJ��mol-1
���б�ʾ�¸�N2O4��Ӧ���Ȼ�ѧ����ʽ����ȷ����
| A��2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ��H="-542.7" kJ��mol-1 |
| B��2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ��H="-1059.3" kJ��mol-1 |
C��N2H4(g)+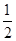 N2O4(g)= N2O4(g)=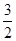 N2(g)+2H2O(g) ��H="-1076.7" kJ��mol-1 N2(g)+2H2O(g) ��H="-1076.7" kJ��mol-1 |
| D��2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ��H="-1076.7" kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��һ�������£�CO��ȼ����Ϊ283 kJ/mol��CH4��ȼ����Ϊ890 kJ/mol����1 mol CO��3 mol CH4��ɻ�����������������³��ȼ�գ��ͷŵ�����Ϊ
| A��2912 kJ | B��2953 kJ | C��3236 kJ | D��3867 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й��ڸ�ͼ�������У���ȷ����
A��ͼ�ױ�ʾ��mol H2 (g)��ȫȼ������ˮ��������241.8 kJ����
B��ͼ�ױ�ʾ2 mol H2(g)�����е�������2 molH2O(g)�����е�������483.6 kJ
C��ͼ�ұ�ʾ������ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����ͬ�¡�ͬŨ�ȵ�NaA��Һ��pHС��NaB��Һ��pH
D��ͼ������ʼʱHA�����ʵ���Ũ�ȴ���HB
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com