
分析 物质导电的条件:含有自由移动的离子或自由电子;
在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
能完全电离的电解质,属于强电解质,只能够部分电离的电解质属于弱电解质;
解答 解:①Na2O 不含自由电子和自由离子,不能导电;熔融状态下能完全电离出只有离子而导电的化合物是电解质,属于强电解质;
②SO3 不含自由电子和自由离子,不能导电;本身不能电离,属于非电解质;
③铁 含有自由电子,能够导电;是单质,既不是电解质,也不是非电解质;
④蔗糖不含自由移动的离子或自由电子,不导电;在水溶液里和熔融状态下都不能导电的化合物是非电解质;
⑤冰醋酸(纯醋酸晶体)不含自由移动的离子或自由电子,不导电;在水溶液中部分电离,属于电解质,是弱电解质;
⑥KNO3晶体不含自由移动的离子或自由电子,不导电;在水溶液里或熔融状态下能完全电离产生自由移动碘离子而导电的化合物是电解质,是强电解质;
⑦氢氧化钠溶液含有自由离子,能够导电;是混合,既不是电解质,也不是非电解质;
(1)能导电的是 ③⑦; (2)属于非电解质的是②④;
(3)属于电解质的是 ①⑤⑥;(4)属于弱电解质的是 ⑤.
故答案为:(1)③⑦(2)②④(3)①⑤⑥(4)⑤.
点评 本题考查了电解质溶液导电的原因及电解质、非电解质、强电解质的定义,熟悉相关概念是解题关键,注意电解质、非电解质都是化合物,单质、混合物既不是电解质也不是非电解质,题目难度不大.


科目:高中化学 来源: 题型:选择题
 、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )
、-COOH,它们两两组成的化合物中,能与氢氧化钠溶液反应的物质种类有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16}{n}$ | B. | n | C. | 16n | D. | 32n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1 mol•L-1 NaNO3 溶液 | B. | 10 mL 1 mol•L-1Al(NO3)3 溶液 | ||
| C. | 15 mL 2 mol•L-1 AgNO3 溶液 | D. | 10 mL 1.5 mol•L-1Cu(NO3)2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: ,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:
,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
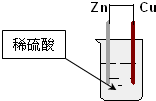
| A. | 铜片表面有气泡产生 | B. | 负极反应为:Cu-2e-=Cu2+ | ||
| C. | 锌为负极,铜为正极 | D. | 电子通过锌片经导线流向铜片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com