

| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x��HI�� | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
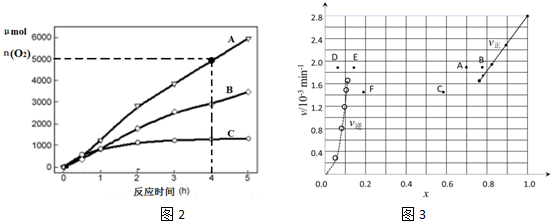
���� ��1�����ݸ�˹���ɣ���ǰ3���Ȼ�ѧ����ʽ���Σ���������Ƴ��Ȼ�ѧʽ2H2O��g��=2H2��g��+O2��g����H4��
��2������ͼ��֪�ù��������ʿ���ѭ�����ã�����Դ��̫���������͵������Դ���ݴ˽��
��3��ʹ�ô��������Խ��ͷ�Ӧ�Ļ�ܣ��������ӵİٷ������ӿ췴Ӧ���ʣ���ͬ�Ĵ����Ի�ܵĸı䲻ͬ�����ݷ�Ӧ���ʿ����жϻ�ܵĴ�С��
����ͼ���ж�0��4Сʱ�������������ʵ��������ù�ʽv��O2��=$\frac{��n��{O}_{2}��}{��t}$���㣻���ݴ˷������
��4���ٱ��е�һ�飬��HI�ֽ⽨��ƽ�⣬���еڶ������淴Ӧ���н���ƽ�⣬�ɵ�һ�����ݿ�֪��ƽ��ʱHI���ʵ�������Ϊ0.784���������������������ʵ�������Ϊ1-0.784=0.216��������������������ʵ���������Ⱦ�Ϊ0.108����Ӧǰ������������䣬�����ʵ�����������Ũ�ȴ���ƽ�ⳣ������ʽK=$\frac{c��{H}_{2}��c��{I}_{2}��}{{c}^{2}��HI��}$���㣻
�ڵ���ƽ��ʱ�������淴Ӧ������ȣ����ƽ�ⳣ������ʽ����֪k���ı���ʽ����t=40minʱ��x��HI��=0.85����������Ӧ���ʱ���ʽv��=k��x2��HI�����㣻
�������¶ȣ������淴Ӧ���ʾ��ӿ죬����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������Ӧ����ƽ�⣬ƽ��ʱHI�����ʵ���������С���淴Ӧ����ƽ�⣬ƽ��ʱH2�����ʵ�����������
��� �⣺��1��2H��aq��?H2��g��+I2��g����H1 ��
SO2��g��+I2��g��+2H2O��g���TH2SO4��J��+2HI��g����H2��
2H2SO4��I��?2H2O��g��+2SO2��g��+O2��g����H3 ��
2H2O��g��=2H2��g��+O2��g����H4 ��
���ݸ�˹���ɢ١�2+�ڡ�2+�۵�2H2O��g��=2H2��g��+O2��g�������ԡ�H4=2��H1+2��H2+��H3 ��
�ʴ�Ϊ��2��H1+2��H2+��H3 ��
��2��������ͼ��֪���ù����������ܹ�ѭ�����ã���Դ����̫���ܣ��ྻ����Ⱦ����ȡ֮��������֮���ߣ�SO2��g��+I2��g��+2H2O��g���TH2SO4��l��+2HI��g���÷�Ӧ����ϵ����С���Ǹ���ֵ��С��Ӧ������S��0����150�������Է�����˵����H-T��S��0����ϡ�S��0�����жϡ�H��0��
�ʴ�Ϊ������ѭ�����ã���Դ����̫���ܣ�����Ⱦ��ȡ֮������֮���ߣ�����Ҫ�㣬һ��������ѭ����һ����������������
��3��A������ͼ����֪��0-4Сʱ��ABC�������������ɵ������������μ��٣������ж������ֲ�ͬ���������·�Ӧ����V��A����V��B����V��C�������ԽС��Ӧ����Խ�죬�ʻ��˳��Ϊ��Ea��A����Ea��B����Ea��C������A����
B��Kֻ���¶��йأ�K����˵���¶Ȳ��䣬��Ӧ�ﵽƽ��״̬����B��ȷ��
C������ͼ���ж�0��4Сʱ�������������ʵ���5000��mol������v��O2��=$\frac{��n��{O}_{2}��}{��t}$=1250��molh-1����C����
D����ͬ�Ĵ�����ͬһ����Ӧ��ܸı�̶Ȳ�ͬ����ܲ�ͬ������ӰٷֱȲ�ͬ����D��ȷ��
�ʴ�Ϊ��BD��
��4���ٱ��е�һ�飬��HI�ֽ⽨��ƽ�⣬���еڶ������淴Ӧ���н���ƽ�⣬�ɵ�һ�����ݿ�֪��ƽ��ʱHI���ʵ�������Ϊ0.784���������������������ʵ�������Ϊ1-0.784=0.216��������������������ʵ���������Ⱦ�Ϊ0.108����Ӧǰ������������䣬�����ʵ�����������Ũ�ȼ���ƽ�ⳣ������ƽ�ⳣ��K=$\frac{c��{H}_{2}��c��{I}_{2}��}{{c}^{2}��HI��}$=$\frac{0.108��0.108}{0.78{4}^{2}}$��
�ʴ�Ϊ��$K=\frac{0.108��0.108}{{{{0.784}^2}}}$��
�ڵ���ƽ��ʱ�������淴Ӧ������ȣ���k��x2��HI��=k��x��H2��x��I2������k��=k����$\frac{{x}^{2}��HI��}{x��{H}_{2}��x��{I}_{2}��}$=$\frac{K��}{K}$��
��t=40minʱ������Ӧ����ƽ���x��HI��=0.85����v��=k��x2��HI��=0.0027min-1��0.852=1.95��10-3min-1��
�ʴ�Ϊ��k��=$\frac{K��}{K}$��1.95��10-3��
�۶���2HI��g��?H2��g��+I2��g����Ӧ����ƽ��ʱ��
�����¶ȣ������淴Ӧ���ʾ��ӿ죬����ų�C�㣬����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ������ƽ�������ƶ����ٴ�ƽ��ʱHI�����ʵ���������С������ų�B�㣬��ѡA�㣻
����H2��g��+I2��g��?2HI��g����Ӧ����ƽ��ʱ��
�����¶ȣ������淴Ӧ���ʾ��ӿ죬�����¶ȣ�ƽ�������ȷ�Ӧ�����ƶ������ƽ�������ƶ����ٴ�ƽ��ʱH2�����ʵ�����������ѡE�㣻
��˷�Ӧ���´ﵽƽ�⣬v����x��HI����Ӧ�ĵ�ΪA��v����x��H2����Ӧ�ĵ�ΪE��
�ʴ�Ϊ��A��E��
���� ���⿼���˸�˹������Ӧ�ȵ�Ӧ�ã���Ӧ�Է����е��оݣ������Է�Ӧ���ʵ�Ӱ�죬��ѧƽ��״̬���жϣ�ƽ�ⳣ���ļ��㣬��Ŀ�ۺ���ǿ����4��Ϊ�״��㣬���ؿ���ѧ����ѧ������������������������ע���������Ϊ��ͬ��������ƽ�⣬��Ŀ��û����ȷ����Ŀ�Ѷ��еȣ�


 ȫ��������ϵ�д�
ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  CH3+Cl2$\stackrel{����}{��}$ CH3+Cl2$\stackrel{����}{��}$ CH2Cl+HCl CH2Cl+HCl | |
| B�� | 2CH3CH2OH+O2$\stackrel{Cu}{��}$ 2CH3CHO+2H2O | |
| C�� | ClCH2�TCH2+NaOH$��_{��}^{ˮ}$ HOCH2CH�TCH2+NaCl | |
| D�� |  +HONO2$��_{��}^{Ũ����}$ +HONO2$��_{��}^{Ũ����}$ NO2+H2O NO2+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ��ɽ�и������¿�����ѧ���������棩 ���ͣ������
����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1 ��2NO(g)+2CO(g)
��2NO(g)+2CO(g) 2CO2(g)+N2(g)��H=��746.5kJ•mol��1������Ϊʹ�ô�����
2CO2(g)+N2(g)��H=��746.5kJ•mol��1������Ϊʹ�ô�����
��֪��2C(s)+O2(g) 2CO(g)��H=��221.0kJ•mol��1
2CO(g)��H=��221.0kJ•mol��1
C(s)+O2(g) CO2(g)��H=��393.5kJ•mol��1
CO2(g)��H=��393.5kJ•mol��1
��N2(g)+O2(g)=2NO(g) ��H = kJ•mol��1��
��2��T ���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10��4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10��3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
��c2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O(g)��CO(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�Ӧ��H2O(g)+CO(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O(g)��ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�
CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�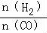 �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��

�� a��b��c���Ӵ�С��˳������Ϊ ��
�� ����ͼ������жϸ÷�ӦΪ ��Ӧ�������Ȼ���ȣ���
��5��CO�����ǵĴ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�� �����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�� �����ĵ缫��ӦʽΪ ��
�� ���������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2 L 0.1 mol/L KCl��Һ���һ��ʱ���ȡ25 mL �����������Һ���μ�0.4 mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ2���㣬����������������һ����̼������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������һ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
����ѧ����ѡ��5���л���ѧ���������ֹ����к������гɷ֣�
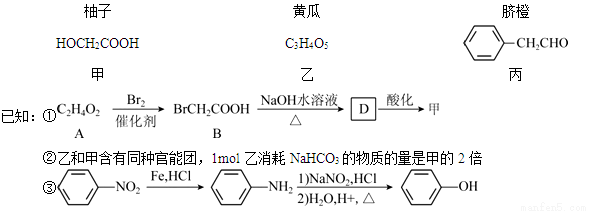
�ش��������⣺
��1��������֪�ٵõ���
�ټ��к��в����ͼ��Ĺ���������Ϊ �����Ա����л��������д��ں��ֹ����ŵ������� ��
��A��BΪȡ����Ӧ��A�Ľṹ��ʽΪ ��
��B��D�Ļ�ѧ����ʽΪ ��
��2������һ���������ܾۺ�������״�����л��߷��ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
��3���ɱ�������;���ɵ�һ����Ҫ��ҽҩ�������м���J�����ַ�Ӧ������ȥ����

������й����ŵ��Լ��� ����Ӧ��������________________��
�ھ�E��G��H�����Ĺ������� ���ݴ��Ƴ�E��G������Ӧ��ȥ�ķ�Ӧ�����Ϊ����һ��__________________���ڶ���____________________��
��J�ж���ͬ���칹�塣����ij�칹��L����״�Ҳ�����֧����L�еĹ����Ŷ�����H2 �����ӳɷ�Ӧ��L�ں˴Ź�����������ʾΪ����壬�������Ϊ3:2����L�Ľṹ��ʽΪ___________��ֻдһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������һ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����c(FeCl3)=0.2 mol��L-1��c(FeCl2)=0.1 mol��L-1�Ļ����Һ�еμ�ϡNaOH��Һ���ɵõ�һ�ֺ�ɫ��ɢϵ�����з�ɢ��������ֱ��ԼΪ9.3 nm�Ľ�������������й�˵������ȷ����
A���÷�ɢϵ�ķ�ɢ��ΪFe2O3
B���ڵ糡�����£�����������ɢϵ��ɫ�����˵���÷�ɢϵ�������
C�����ù��˵ķ�������ɫ������������Na+���뿪
D������NaOHʱ�����ķ�Ӧ����Ϊ��Fe2++2Fe3++8OH-=Fe3O4+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѹǿ/MPa | 10 | 20 | 30 | 40 |
| �գ�NH3�� | 0.30 | 0.45 | 0.54 | 0.60 |
| A�� | 10 MPaʱ��H2��ת����Ϊ75% | |
| B�� | 20 MPaʱ��NH3�����ʵ���Ũ����10 MPaʱ��1.5�� | |
| C�� | 40 MPaʱ�������������ΪVL����ƽ�ⳣ��$K=\frac{{64{V^2}}}{3}$ | |
| D�� | 30 MPaʱ�����������г���������壬��ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǰ10min��Ӧ��ƽ������v��C��=0.1 mol/��L•min�� | |
| B�� | ��Ӧ�ﵽƽ��ʱB��ƽ��Ũ����1.5 mol•L-1 | |
| C�� | �����£�����Ӧ�������ѹ��Ϊԭ����һ�룬��D��ƽ��Ũ��С��1.0 mol•L-1 | |
| D�� | 10 min���������м���A�����½���ƽ��ʱA��ת����һ������50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1}{2}$N2H4��g��+$\frac{1}{2}$O2��g���T$\frac{1}{2}$N2��g��+H2O��l����H=-267 kJ•mol-1 | |
| B�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=-133.5 kJ•mol-1 | |
| C�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=+534 kJ•mol-1 | |
| D�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=-534 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com