
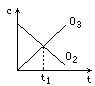
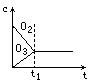
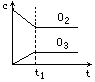
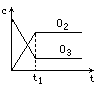
将5mol·L-1的O2在高温下放电,经时间t1后,建立了3O2![]() 2O3的平衡体系,测知氧气的转化率为20%,则如图中所示图像正确的是
2O3的平衡体系,测知氧气的转化率为20%,则如图中所示图像正确的是
[ ]
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
《环境空气质量标准》中,有害气体的浓度常用标准状况下,每立方米气体中含有害气体的毫克值(mg/m3)来表示,对CO的浓度限值规定为:
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
① 首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2(不考虑其他气体的反应);
② 用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下:

(1) 写出中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下图中序号①~④仪器的名称:
![]()
![]()

I II III
① ;② ; ③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)分离碘水中的碘应先选择装置 (填装置序号) 进行 和 操作 ,再用装置 (填装置序号)进行 操作。
(4)现欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、 __________、 __________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A取浓硫酸时俯视
B将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E 颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二上学期期中考试化学试卷 题型:选择题
某同学做丙醛的还原性实验,取4 mL 0.5mol·L-1的CuSO4溶液和4 mL 0.5 mol·L-1的NaOH溶液,将它们混合后,滴入1.0 mL的10%丙醛溶液,加热煮沸,结果没有看到红色沉淀生成,这是因为 ( )
A.麦芽糖溶液太浓 B.加热时间不够
C.CuSO4溶液不够量 D.NaOH溶液不够量
查看答案和解析>>
科目:高中化学 来源:2010年新疆乌鲁木齐一中高一上学期期末考试物理试卷 题型:选择题
一定量的锌与100mL18.5mol·L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1。则生成的气体中SO2和H2的体积比为( )
A.1:2 B.2:1 C.1:4 D.4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com