
(10分)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为_____________________________________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_ ___。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
| 实验 编号 |
实验目的 | T/K | 催化剂用量/g | C/mol?l-1 | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | 323 | 0.5 | 0.01 | 0.1 | |
| ④ | 探究催化剂对反应速率的影响 | 0.1 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(17分)具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1) 草酸(H2C2O4)分解的化学方程式 为: ,
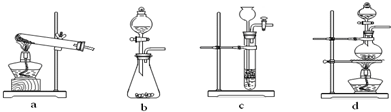
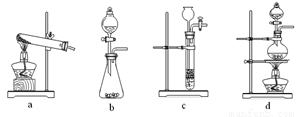
下列装置中,可用于草酸分解制取气体的是 。(填字母)
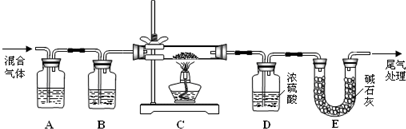
(2) 某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答:
① 为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
② 在点燃酒精灯之前应进行的操作是:(a) ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n= (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是 (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3) 该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | C/mol·l-1:] | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ |
| 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化剂对反应速率的影响 |
|
|
| 0.1 |
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2014届河南省郑州市智林学校高一上学期期中考试化学试卷(解析版) 题型:选择题
(10分)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为_____________________________________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_ ___。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省南平市毕业班适应性考试(理综)化学部分 题型:实验题
(17分)具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1) 草酸(H2C2O4)分解的化学方程式 为: ,
下列装置中,可用于草酸分解制取气体的是 。(填字母)
(2) 某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答:
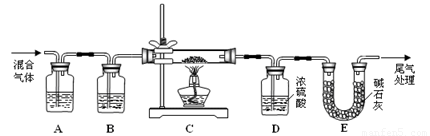
① 为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
② 在点燃酒精灯之前应进行的操作是:(a) ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是 (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3) 该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
|
实验 编号 |
实验目的 |
T/K |
催化剂用量/g |
C/mol·l-1:] |
|
|
KMnO4 |
H2C2O4 |
||||
|
① |
为以下实验作参考 |
298 |
0.5 |
0.01 |
0.1 |
|
② |
探究KMnO4酸性溶液的浓度对该反应速率的影响 |
298 |
0.5 |
0.001 |
0.1 |
|
③ |
|
323 |
0.5 |
0.01 |
0.1 |
|
④ |
探究催化剂对反应速率的影响 |
|
|
|
0.1 |
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com