
| A.制备粗硅不涉及氧化还原反应 |
| B.光导纤维的主要成份是二氧化硅 |
| C.二氧化硅是H2SiO3的酸酐,因此能与水反应,也能与碱溶液反应 |
| D.常温时硅既能与盐酸反应,也能与烧碱溶液反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅可用作半导体材料 |
| B.硝酸常用作金属铜加工前的酸洗 |
| C.碳酸钠可用于治疗胃酸过多 |
| D.三氧化二铁常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 |
| B.光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 |
| C.高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点 |
| D.光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| B.镁、铝具有一定的抗腐蚀性,是因为镁、铝不易被氧化 |
| C.84消毒液的主要成分是NaClO |
| D.某些金属元素的焰色反应、海水提溴、煤的液化、石油的裂化都是化学变化的过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
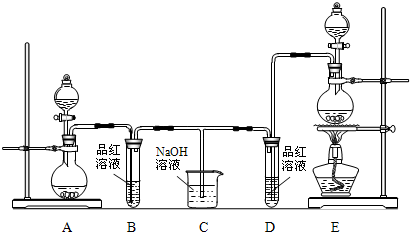
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸 | B.氢氧化钠溶液 |
| C.水 | D.饱和食盐水 |
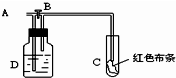
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
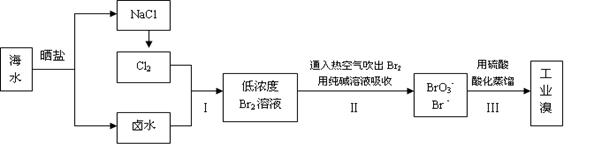

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com