
| A. | SO2+2NaOH═Na2SO3+H2O | |
| B. | SiH4+2H2O+8AgNO3═8Ag↓+SiO2↓+8HNO3 | |
| C. | Na2O+H2O═2NaOH | |
| D. | Al(OH)3+NaOH═Na[Al(OH)4] |
分析 属于氧化还原反应,说明反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答 解:A.该反应中所有元素化合价不变,没有电子转移,不属于氧化还原反应,故A错误;
B.该反应中Ag元素化合价由+1价变为0价、Si元素化合价由-4价变为+4价,所以有电子转移,属于氧化还原反应,故B正确;
C.该反应中所有元素化合价不变,没有电子转移,不属于氧化还原反应,故C错误;
D.该反应中所有元素化合价不变,没有电子转移,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应判断,为高频考点,明确氧化还原反应本质及特征是解本题关键,知道常见元素化合价,易错选项是D,注意D中Al元素化合价都是+3价.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁带中混有与酸不反应的杂质 | |
| B. | 装置接口连接处有气体泄漏 | |
| C. | 液体量瓶刻度读数未扣去硫酸的体积 | |
| D. | 硫酸注入量不足,镁带未反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、SO42-、Cl- | B. | K+、OH-、HCO3- | C. | Mg2+、SO42-、Cl- | D. | Cu2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
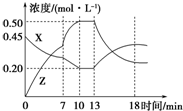 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+Y(g)?2Z(g)△H<0.如图所示是容器中X、Z的物质的量浓度随时间变化的曲线.下列关于在第7min 时和第13min时曲线变化的可能原因推测正确的是( )| A. | 第7 min时升高温度、第13 min时降低温度 | |
| B. | 第7 min时使用催化剂、第13 min时升高温度 | |
| C. | 第7 min时降低温度、第13 min时增大压强 | |
| D. | 第7 min时减小压强、第13 min时升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com