
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17g NH3所含质子数为10 NA | D. | 18g水所含分子数目为18NA |
分析 A、先求出镁的物质的量,然后根据1mol镁含12mol电子来计算;
B、先求出甲烷的物质的量,然后根据1molCH4含5mol原子来分析;
C、先求出氨气的物质的量,然后根据1molNH3含10mol质子来分析;
D、求出水的物质的量,再根据N=n•NA来计算.
解答 解:A、镁的物质的量n=$\frac{m}{M}$=$\frac{2.4g}{24g/mol}$=0.1mol,而1mol镁含12mol电子,故0.1mol电子含1.2mol电子,故A错误;
B、甲烷的物质的量n=$\frac{m}{M}$=$\frac{16g}{16g/mol}$=1mol,而1molCH4含5mol原子,故B错误;
C、氨气的物质的量n=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,而1molNH3含10mol质子,故C正确;
D、水的物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol,分子数N=n•NA=NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在反应中氧化剂是Na2O2,还原剂是FeSO4 | |
| B. | 生成2molNa2FeO4时,反应中共有8mol电子转移 | |
| C. | 反应中生成22.4LO2时,共有10mol电子转移 | |
| D. | Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Cu、Ag分别作原电池两电极,AgNO3溶液作电解质溶液 | |
| B. | 用Ag作电解池的阳极,石墨作电解池的阴极,CuSO4溶液作电解质溶液 | |
| C. | 用Ag、C分别作原电池两电极,CuSO4溶液作电解质溶液 | |
| D. | 用Ag作电解池的阳极,石墨作电解池的阴极,AgNO3溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
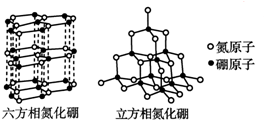 新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.
新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.5 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为1 NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6g Fe与足量稀盐酸反应,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,DA4的结构式为
,DA4的结构式为 ;
;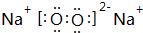 ,D元素在周期表中的位置第二周期IVA族;
,D元素在周期表中的位置第二周期IVA族;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com