
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH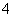 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2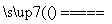 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO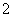 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
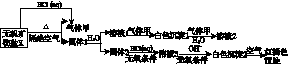
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为__________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_____________________________________________________,并设计实验方案验证该反应的产物:__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLzxxk
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整:
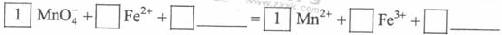
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
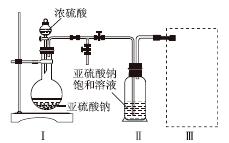
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
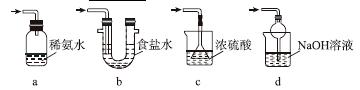
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com