
��������ͼ�������˵����ȷ����

A������Aͼ���жϣ�2O3��g��=3O2��g������H=-44.8KJ/mol
B������Bͼ���ж�A��g�� 2C��g����ʹ�ô���ʱ�ķ�Ӧ���ʴ������Saco>Sbdo
2C��g����ʹ�ô���ʱ�ķ�Ӧ���ʴ������Saco>Sbdo
C������Cͼ���ж�2A��g�� C��g���ں��º�ѹʱ�ٳ���A��g����t4���´ﵽƽ��ʱ����һƽ��Ϊ��Чƽ��
C��g���ں��º�ѹʱ�ٳ���A��g����t4���´ﵽƽ��ʱ����һƽ��Ϊ��Чƽ��
D��Dͼ��ʾ2NO2��g�� N2O4��g����Ӧ��������������ͬʱ���ı�ѹǿ�ﵽƽ��ʱc��NO2���仯�������P1>P2
N2O4��g����Ӧ��������������ͬʱ���ı�ѹǿ�ﵽƽ��ʱc��NO2���仯�������P1>P2
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��14�֣��Ȼ���������ض��dz�����ˮ����������ͼΪ�Ʊ��Ȼ�������һ�������Ʊ�������صĹ������̡�
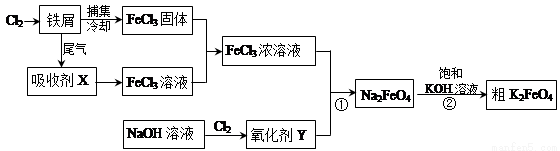
��ش��������⣺
��1���Ȼ����ж�����;���������ӷ���ʽ��ʾ������;��ԭ����
���Ȼ�������ˮ��______________________����2�֣�
����FeCl3��Һ��32%��35%����ʴͭӡˢ��·��_________________________����2�֣�
��2�����ռ�X�Ļ�ѧʽΪ ����1�֣�������Y�Ļ�ѧʽΪ____________����1�֣�
��3�����������·�Ӧ�ٵ����ӷ���ʽΪ____________________________________����2�֣�
��4�����̢ڽ������Һ�����Сʱ�����ã����˻�ôֲ�Ʒ���÷�Ӧ�Ļ�ѧ����ʽΪ2KOH+Na2FeO4��K2FeO4+2NaOH������ݸ��ֽⷴӦԭ��������Ӧ������ԭ��_____ ����2�֣�
��5��K2FeO4 ��ˮ��Һ��������Ӧ��4FeO42+10H2O 4Fe(OH)3+8OH+3O2�������ᴿK2FeO4ʱ�����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ������ţ�����2�֣�
4Fe(OH)3+8OH+3O2�������ᴿK2FeO4ʱ�����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ������ţ�����2�֣�
A��H2O
B��ϡKOH��Һ�������
C��NH4Cl��Һ�������
D��Fe(NO3)3��Һ�������
��6�����õζ��������ⶨ��K2FeO4�Ĵ��ȣ��йط�Ӧ���ӷ���ʽΪ��
��FeO42-��CrO2-��2H2O CrO42-��Fe(OH)3����OH-
CrO42-��Fe(OH)3����OH-
��2CrO42-��2H�� Cr2O72-��H2O
Cr2O72-��H2O
��Cr2O72-��6Fe2����14H�� 2Cr3����6Fe3����7H2O
2Cr3����6Fe3����7H2O
�ֳ�ȡ1��980 g�ָ��������Ʒ������������������Һ�У������Թ�����KCrO2����ַ�Ӧ�������Һ������250 mL����ƿ�С�ÿ��ȡ25��00 mL����ϡ�����ữ����0��1000 mol/L��(NH4)2Fe(SO4)2����Һ�ζ������εζ����ı���Һ��ƽ�����Ϊ18��93 mL����������Ʒ�и�����ص���������Ϊ ����2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����Xֻ������A1����NH4)2SO4 ��MgCl2��FeCl2, AlCl3, AgNO3�е�һ�ֻ�����ɣ�ijͬѧ�Ըù������������ʵ��
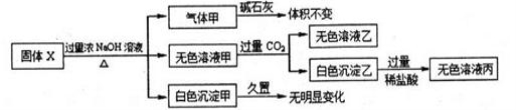
�����ж���ȷ����
A�������һ���Ǵ����� B������X��һ��������FeCl2��AgNO3
C����ɫ���������ǻ���� D������X��һ������AlCl3��(NH4)2SO4, MgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶�������ѡ��ѧ�Ծ��������棩 ���ͣ������
��10�֣�NH3��һϵ�з�Ӧ���Եõ�HNO3��NH4NO3������ͼ��ʾ��

��1��I�У�NH3��O2�ڴ��������·�Ӧ���仯ѧ����ʽ�� ��
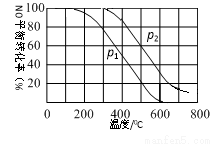
��2��II�У�2NO(g)+O2(g)  2NO2(g) ����ʼʱ��������1molNO��0.5molO2���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ(p1��p2)�����¶ȱ仯������(����ͼ)��
2NO2(g) ����ʼʱ��������1molNO��0.5molO2���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ(p1��p2)�����¶ȱ仯������(����ͼ)��
�ٱȽ�p1��p2�Ĵ�С��ϵ ��
�����¶�Ϊ500�桢ѹǿΪp2�����£�ƽ��������NO2��������� ��
��3��III�У���NO2(g)ת����N2O4(l)�����Ʊ�Ũ���ᡣ
����֪��2NO2(g)  N2O4(g) ��H1 2NO2(g)
N2O4(g) ��H1 2NO2(g)  N2O4(l) ��H2
N2O4(l) ��H2
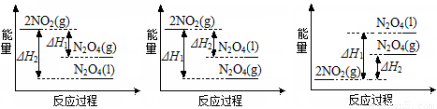
A B C
��Ӧ�����������仯��ȷ���� ������ţ���
��N2O4��O2��H2O���ϵĻ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й������ʵ���Ũ�ȱ�����ȷ����
A��0.2mol��L��1Na2SO4��Һ�к���Na+��SO42�������ʵ���Ϊ0.6mol
B��50mL2mol��L��1NaCl��Һ��100mL0.5mol��L��1MgCl2��Һ�У�Cl�������ʵ���Ũ�����
C����1Lˮ����22.4L�Ȼ������������Ũ����1mol��L��1
D��10g98%�����ᣨ�ܶ�Ϊ1.84g��cm��3����10mL18.4mol��L��1�������Ũ������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ�����и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ����֪��Ӧ���̷��ȣ����������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ����ͼ��ʾ������˵����ȷ����

A�����Լ���Һ��KOH�����ʵ�����0.09mol
B��ClO3�����������������������Ķ��������
C��������������ClO����ClO3��������Cl2
D����Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ��9���ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪25��ʱ����HF��aq����OH����aq�� F����aq��+H2O��l�� ��H����67.7 kJ/mol
F����aq��+H2O��l�� ��H����67.7 kJ/mol
��H����aq����OH����aq��===H2O��l�� ��H����57.3 kJ/mol�����й�˵������ȷ����
A��HF���룺HF��aq�� H����aq��+F����aq����H=+10.4KJ/mol
H����aq��+F����aq����H=+10.4KJ/mol
B��ˮ������0.1 mol F��ʱ�����յ�����Ϊ6.77 kJ
C���к��Ⱦ�Ϊ57.3 kJ/mol
D����0.1 mol HF��0.1 mol NaOH��������Һ��Ϻ�ų�������Ϊ6.77 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�ĵ���У�߶���ѧ��10��������ѧ�Ծ��������棩 ���ͣ������
��1��������ͼ��ʾ������ж�����˵������ȷ���� ��
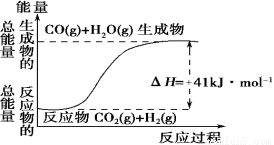
A�����Ȼ�ѧ����ʽΪ��CO(g)+H2O(g)=CO2(g)+H2(g) ��H��41 kJ��mol��1
B���÷�ӦΪ���ȷ�Ӧ
C���÷�ӦΪ���ȷ�Ӧ
D������H2OΪҺ̬ʱ��Ӧ��Ϊ��H2����H2����H
��2��25�桢101 kPa�£���֪1g������ȫȼ������Һ̬ˮʱ�ų�142.9 kJ���������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��3����֪��Ӧ�� N2(g) �� O2 (g) �� 2NO(g) ��H1
2H2(g) �� O2(g) �� 2H2O(g) ��H2
N2(g) �� 3H2(g) �� 2NH3(g) ��H3
��������������Ӧ������4NH3(g) + 5O2(g) �� 4NO(g) + 6H2O(g) ��H4 �ķ�Ӧ�ʱ�Ϊ (�ú���H1����H2����H3��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鲻�ܻ�óɹ�����
���ü�������ͨ���ˮ�Ƶ����
�ڼ������������Ϲ�����ȡ������һ�����
���������Ƽ��ȼ���������ȡ̿�ں�����
A��ֻ�Т� B��ֻ�Т� C��ֻ�Т� D���٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com