
【题目】NH3及其盐都是重要的化工原料. 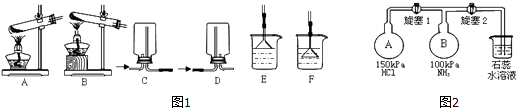
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为;该反应发生、气体收集和尾气处理装置如图1依次为;
(2)按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是 , 稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是;
(3)写出NH4Cl溶液水解的离子方程式;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | … | |
1 | 250 | X | … | ||
2 | 250 | … |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为(只列出算式,忽略水自身电离的影响).
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;BDE
CaCl2+2NH3↑+2H2O;BDE
(2)产生白色的烟;烧杯中的石蕊溶液会倒吸入B瓶,且溶液变为红色
(3)NH4++H2O?NH3?H2O+H+;温度;pH;m;T1;m;T2;Y;![]()
【解析】解:(1)NH4Cl和Ca(OH)2在加热条件下生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;反应物为固体与固体和反应条件为加热,所以选择B发生装置,氨气易溶于水,密度小于空气密度应选择向下排空气法收集,所以选择D收集装置,氨气极易溶于水,可以用水吸收,注意防止倒吸的发生,可选择E做尾气处理装置;所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;反应物为固体与固体和反应条件为加热,所以选择B发生装置,氨气易溶于水,密度小于空气密度应选择向下排空气法收集,所以选择D收集装置,氨气极易溶于水,可以用水吸收,注意防止倒吸的发生,可选择E做尾气处理装置;所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;BDE;(2)氯化氢与氨气反应生成白色固体氯化铵,所以看到现象为:产生白色的烟;氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子和铵根离子,溶液显碱性,所以看到现象为:烧杯中的石蕊溶液会倒吸入B瓶,且溶液变为红色;所以答案是:产生白色的烟;烧杯中的石蕊溶液会倒吸入B瓶,且溶液变为红色;(3)氨根离子为弱碱阳离子,水解生成一水合氨和氢离子,水解的离子方程式:NH4++H2ONH3H2O+H+;所以答案是:NH4++H2ONH3H2O+H+;
CaCl2+2NH3↑+2H2O;BDE;(2)氯化氢与氨气反应生成白色固体氯化铵,所以看到现象为:产生白色的烟;氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子和铵根离子,溶液显碱性,所以看到现象为:烧杯中的石蕊溶液会倒吸入B瓶,且溶液变为红色;所以答案是:产生白色的烟;烧杯中的石蕊溶液会倒吸入B瓶,且溶液变为红色;(3)氨根离子为弱碱阳离子,水解生成一水合氨和氢离子,水解的离子方程式:NH4++H2ONH3H2O+H+;所以答案是:NH4++H2ONH3H2O+H+;
①盐类水解,水解离子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,所以答案是:温度;②根据①可知,该实验为探究温度对氯化铵水解的影响,氯化铵为强酸弱碱盐,水解溶液呈酸性,所以可根据不同温度下,水解的溶液的pH进行判断,所配制溶液的体积都为100mL,m(NH4Cl)相同都为m g,温度不同,分别为T1℃、T2℃,分别测水解后pH;所以答案是:
物理量 | V(溶液)/mL | NH4Cl质量(g) | 温度(℃) | pH | … |
1 | m | T1 | … | ||
2 | m | T2 | Y | … |
③读取的待测物理量的数值为X,X为pH值,pH=﹣lgc(H+),c(H+)=10﹣Xmol/L,NH4++H2ONH3H2O+H+ , 水解的氯化铵的物质的量为n(NH4Cl)=c(H+)×V=10﹣X×0.25mol,则NH4Cl水解反应的平衡转化率为: ![]() ×100%=
×100%= ![]() ×100%;所以答案是:
×100%;所以答案是: ![]() .
.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,A是水果的催熟剂,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸.几种物质之间的转化关系如图所示(生成物中所有无机物均已略去). 
请回答下列问题:
(1)写出物质的结构简式:A、C、E .
(2)在①~⑥6个反应中,属于消去反应的是(填编号).
(3)写出下列反应的化学方程式:
①;
②;
⑥ .
H→I反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 非金属氧化物都是酸性氧化物 B. 金属氧化物都是碱性氧化物
C. 氧气与臭氧属于同素异形体 D. 氧化物都可以直接和水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的产生与停止
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:请回答下列问题: 
(1)白色沉淀B中金属元素的离子结构示意图为 , A的电子式为 .
(2)步骤3中生成沉淀C的离子方程式为 .
(3)X的化学式为 , 该抗酸药不适合胃溃疡重症患者使用,原因是 .
(4)设计实验方案验证步骤3后得到的无色溶液中的含碳离子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4g铜和三氧化二铁的混合粉末加入到溶液为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,则V的取值范围为 .
(2)若硫酸溶液过量,反应后的溶液体积为1L,测得此溶液中Fe2+浓度为0.1mol/L,则原混合物中含铜g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 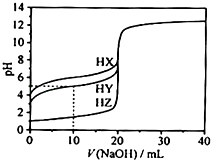
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、H+、S2-B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-D.SO32-、NO3-、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com