
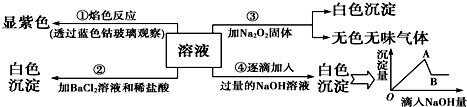
分析 溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含有色离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,
加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,有Al3+则无CO32-.据此分析.
解答 解:溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+、Fe2+、Cu2+,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,一定不含CO32-,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,一定不含有铵根离子,综上可知:原溶液中一定含有Al3+、Mg2+、K+、SO42-,一定不含Fe3+、Fe2+、NH4+、Cu2+、CO32-.
(1)原溶液中一定存在的离子有(写化学式):Al3+、Mg2+、K+、SO42-,是强酸弱碱盐溶液,原溶液可能呈酸性,故答案为:Al3+、Mg2+、K+、SO42-;酸;
(2)由于溶液中含Al3+、Mg2+、K+、SO42-,故加入氢氧化钠溶液后,产生的沉淀有:Al(OH)3、Mg(OH)2.由A→B过程是氢氧化钠溶液过量,生成的Al(OH)3沉淀溶于过量的氢氧化钠溶液,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3、Mg(OH)2;Al(OH)3+OH-═AlO2-+2H2O;
(3)实验③中产生无色无味气体是过氧化钠与水反应,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑;
(4)实验②中加入稀盐酸能排除碳酸根的干扰,确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀,故答案为:确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀.
点评 本题考查了焰色反应、常见的有色离子、离子的水解、离子反应的条件,Al(OH)3的化学性质,涉及的知识点较多,若是基础知识不扎实,恐怕难以完成.


科目:高中化学 来源: 题型:选择题
| A. | b、d、e | B. | b、c、e、f | C. | a、b、c | D. | b、c、d、e |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是一个放出热量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,2SO2+O2?2SO3是一个放热反应,则2SO3?2SO2+O2是一个吸热反应 | |
| D. | 73 g氯化氯具有的能量大于2 g氢气和71 g氯气具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高于409 K | B. | 低于136 K | ||
| C. | 高于136 K而低于409 K | D. | 低于409 K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡不发生移动 | B. | 平衡沿着逆反应方向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com