
(6分)联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
| A.联氨(N2H4)结构与C2H4相似,存在N=N双键 | |
| B.一分子联氨中含有的电子对数目为5 | C.联氨中的N原子的杂化类型为sp3杂化 |
| D.联氨能与HCl发生化合反应生成N2H6Cl2 |
科目:高中化学 来源: 题型:
(6分)联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B.一分子联氨中含有的电子对数目为5
C.联氨中的N原子的杂化类型为sp3杂化
D.联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式 ;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二下学期期末考试化学 题型:实验题
(6分)联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B.一分子联氨中含有的电子对数目为5
C.联氨中的N原子的杂化类型为sp3杂化
D.联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式 ;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:北京模拟题 题型:填空题
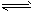 1/2N2O4(g) △H=- 26. 35 kJ/mol
1/2N2O4(g) △H=- 26. 35 kJ/mol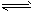 1/2N2O4(g)的影响如图所示。
1/2N2O4(g)的影响如图所示。 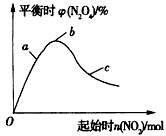
①在图中用虚线画出400℃时对应的图象;
②a、b、c三点中,NO2的转化率最高的是____(填字母)。
(4)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3)变成磁性氧化铁(Fe3O4)层,从而减缓锅炉锈蚀。若反 应过程中联氨转化为氮气,则每生成1 mol Fe3O4,转移电子的物质的量为_______________。
(5)联氨-空气燃料电池是一种碱性电池,电解质溶液是20% ~30%的氢氧化钾溶液。该电池放电时,负极的反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B.一分子联氨中含有的电子对数目为5
C.联氨中的N原子的杂化类型为sp3杂化
D.联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式 ;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com