
下列图示与对应的叙述相符的是 ( )
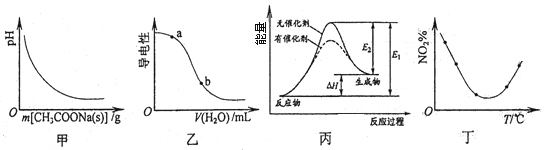
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
【答案】D
【解析】
试题分析:A.CH3COOH是弱酸,在溶液中存在电离平衡,若向CH3COOH溶液中逐步加入CH3COONa固体,则增大生成物的浓度,电离平衡逆向移动,溶液中c(H+)减小后,溶液pH比原大,错误;B.向CH3COOH溶液中加水时醋酸的电离平衡正向移动,但是由于稀释作用使离子浓度减小的趋势大于平衡移动使离子浓度增大的趋势,所以溶液的导电性逐渐减弱,由于加水b>a,所以CH3COOH溶液的离子浓度a>b,所以pH:a<b,错误;C.图丙表示催化剂能改变化学反应的活化能,但是不能改变反应的焓变,错误;D.当反应达到平衡后,升高温度,NO2的含量逐渐增加,根据平衡移动原理可知:生成O2的方向是吸热反应,所以反应:2NO2(g) N2O4(g)的正反应是放热反应,所以△H<0,正确。
N2O4(g)的正反应是放热反应,所以△H<0,正确。
考点:考查图像法在物质的电离和化学反应速率及化学平衡中的应用的知识。


科目:高中化学 来源: 题型:
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2
C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有Na HCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
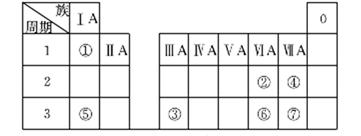
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质与应用的说法正确的是 ( )
A.碳具有还原性,高温条件下能将二氧化硅还原为硅
B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用
C.二氧化硅是半导体材料,可将太阳能直接转化为电能
D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg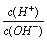 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )

A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol·L-1的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:

请回答下列问题:
(1)美托洛尔中的含氧官能团为 和 (填名称)。
(2)反应③中加入的试剂X的分子式为C2H5OCl,X的结构简式为 。
(3)在上述①②③三步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应 Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢,且1 mol该物质与金属钠反应产生 1 mol H2。
写出一种该同分异构体的结构简式: 。
(5)根据已有知识并结合题目所给相关信息,写出以CH3OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
下列生产或实验事实引出的相应结论不正确的是( )
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)⇌N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各化学反应的离子方程式中,有错误的是( )
A.铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O
C.碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br-
D.碳酸氢镁溶液中加过量澄清石灰水
Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com