
【题目】有四种短周期主族元素z、e、g、h,其最高价氧化物对应水化物溶液(浓度均为0.01molL﹣1)的pH与原子序数的关系如图所示。下列说法正确的是

A. 离子半径大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有离子键有含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值 h >g> z
【答案】C
【解析】由图象可知,四种元素最高价氧化物对应的水化物溶液的浓度为0.01mol/L,其中z对应pH为2,即为强酸,结合原子序数可知z为N元素,e对应的pH为12,即为强碱,所以e为Na元素,所以推出g为S元素,h为Cl元素。所以Na、S、Cl的离子半径大小为S2->Cl->Na+,即g>h>e,所以A错误;S元素位于第三周期ⅥA族,则B错误;C、e2g2即Na2S2,类似于Na2O2,所以分子内既含有离子键,又含有非极性共价键,所以C正确;D、h、g、z三种元素的简单氢化物分别为HCl、H2S、NH3,同浓度时三者水溶液的pH大小关系为NH3> H2S> HCl,即z >g >h,所以D错误。本题正确答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示:己知草酸的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5 下列叙述正确的是( )

A. 曲线I表示H2C2O4的变化
B. pH=4时,c(HC2O4-)>c(C2O42-)
C. c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等
D. 常温下,  随pH的升高先增大后减小
随pH的升高先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.CaCO3的分解反应B.灼热的炭与CO2反应
C.铝与稀盐酸反应D.稀H2SO4与稀KOH的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含原子个数由大到小的顺序正确的是( )
①0.3molNH3 ②标准状况下22.4L氯气 ③9mL H2O (4℃) ④0.2mol H3PO4
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为( )
A. 2(b-a)mol/L B. 2(b-2a)mol/L C. 4(b-a)mol/L D. 4(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:

已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)
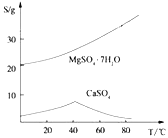
根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,分别向密闭容器内可移动活塞的两边充入空气,H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为

A.2∶7 B.5∶4 C.2∶1 D.7∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com